
【题目】将1.5 mol Cu2S和足量稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O。则参加反应的硝酸中被还原的硝酸的物质的量是
A. 5 mol B. 1.5 mol C. 6 mol D. 1mol
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答下列问题:

(1)元素③形成的单质的电子式为_________;元素②形成的最高价氧化物的结构式为________。
(2)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是_________(填化学式),沸点最高的是__________(填化学式)。
(3)元素⑩在周期表中的位置_________;该元素的单质主要用途________(填一种)。
(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较__________(填化学式)。
(5)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为___________。
(6)用电子式表示⑥、⑧两元素结合成化合物的形成过程__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)是一种无色的可燃液体。请回答下列问题:
(1)联氨是火箭的重要燃料。已知:
(a) N2H4(l)的燃烧热ΔH1 = –624.0 kJmol–1
(b) ![]() ΔH2 = –66.4 kJmol–1
ΔH2 = –66.4 kJmol–1
(c) ![]() ΔH3 = –28.6 kJmol–1
ΔH3 = –28.6 kJmol–1
写出N2H4(l)在N2O4(g)中燃烧生成氮气和液态水的热化学方程式________________。
(2)N2H4能使锅炉内壁的铁锈(主要成分为Fe2O3xH2O)变成磁性氧化铁,从而可减缓锅炉锈蚀。反应过程中每生成0.1 mol磁性氧化铁,转移的电子数为_________________。
(3)联氨-空气燃料电池的电解质为KOH溶液。写出该电池放电时负极的反应式________。
(4)联氨的制备方法有多种,尿素法是其中之一。在KMnO4的催化作用下,尿素CO(NH2)2和NaClO、NaOH溶液反应生成联氨、水和两种钠盐,写出该反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
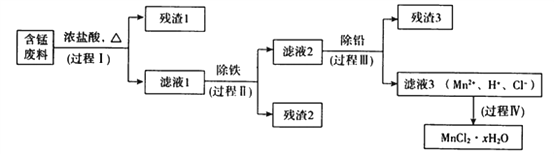
资料a.Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1 mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnOOH与浓盐酸反应的离子方程式是_______________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:_________________________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3+2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.……
写出c的离子方程式:____________________。
(2)过程Ⅱ的目的是除铁。有如下两种方法,
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于5.5。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②两种方法比较,氨水法除铁的缺点是____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是____________。
(4)过程Ⅳ所得固体中的x的测定如下,取m1g样品,置于氯化氢氛围中加热至失去全部结晶水时,质量变为m2g。则x=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是
A. 在标准状况下,2.24LSO3中含氧原子数为0.3NA
B. 1L0.1mol/L(NH4)2Fe(SO4)2溶液中,阳离子总数为0.3NA
C. 常温常压下,4.2g乙烯和环丙烷的混合气体中所含原子总数为0.9NA
D. 将0.1molCl2通入足量热的浓NaOH溶液中完全反应生成NaCl、NaClO3和水,转移电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定已部分变质的过氧化钠(假定杂质全部为碳酸钠)的纯度,设计了如下图所示的实验.图中Q为一具有良好弹性的气球(气球不参与反应,也不会被腐蚀),称取一定量的样品放入其中,按图安装的实验装置打开分液漏斗的活塞,将稀硫酸滴入气球中.请填空:
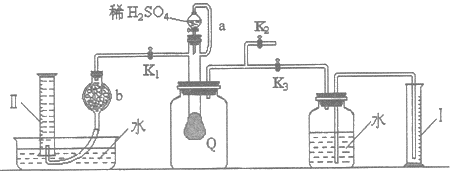
(1)Q内发生反应生成了两种气体,这两种气体的分子式为O2、CO2,写出反应的离子方程式:________。
(2)导管a的作用是________。
(3)为测定反应生成气体的总体积,滴稀硫酸前必须关闭________(填K1、K2、K3,下同),打开________。
(4)当上述反应停止后将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是________。
(5)b中装的固体试剂是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.06molFeCl2加入100mLK2Cr2O7溶液中,恰好使溶液中Fe2+全部转化为Fe3+ , Cr2O72﹣还原为Cr3+ . 则K2Cr2O7溶液的物质的量浓度为( )
A.0.05mol/L
B.0.1mol/L
C.0.2mol/L
D.0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
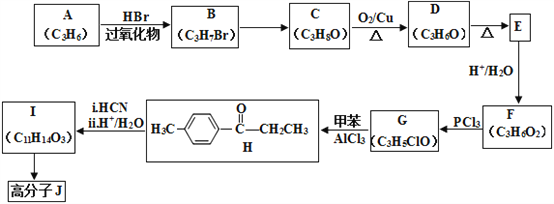
【题目】高分子合物J的合成路线如下:
已知:i. 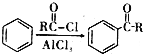
ii. 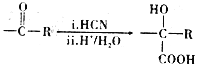
(1)写出A的结构简式:________________________。
(2)由B→C的反应条件为:________________,反应类型为:_________________。
(3)H中官能团名称:________________________。
(4)D 与新制的银氨溶液反应生成E的化学方程式:__________________________________________。
(5)由I合成高分子化合物J的化学方程式为____________________________________。
(6)有机物L(C9H10O3)符合下列条件的同分异构体有___________种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基,且只有一个烷基
(7)结合上述流程中的信息,设计由![]() 制备
制备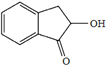 的合成路线。合成路线流程图示例:
的合成路线。合成路线流程图示例:
H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5,______________________。
CH3COOC2H5,______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com