
按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A的原子中只有一个电子层且只含1个电子;B的原子3p轨道上得到1个电子后不能再容纳外来电子;C的原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D的原子第三电子层上有8个电子,第四电子层上只有1个电子;E原子的外围电子排布式为3s23p6。
(1)写出A、B、C、D四种元素的元素符号:________________________________。
(2)检验某溶液中是否含有D+,可通过________反应来实现;检验某溶液中是否含有B-,通常所用的试剂是__________和__________。
(3)写出E的元素符号________,要证明太阳上是否含有E元素,可采用的方法是______。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某种元素原子的质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )
A.由已知信息可得NA=
B.W g该原子的物质的量一定是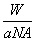 mol
mol
C.W g该原子中含有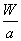 个该原子
个该原子
D.该原子的摩尔质量是aNA g
查看答案和解析>>
科目:高中化学 来源: 题型:
把200 mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为( )
A.(10b-5a)mol·L-1 B.(2b-a)mol·L-1
C.( -
-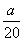 )mol·L-1 D.(5b-
)mol·L-1 D.(5b-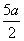 )mol·L-1
)mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
如果取一块冰放在容器里,不断地升高温度,可以实现“冰→水→水蒸气→氢气和氧气”的变化,在各步变化时破坏的粒子间的相互作用力依次是( )
A.氢键、极性键、非极性键
B.氢键、氢键、极性键
C.氢键、氢键、非极性键
D.氢键、非极性键、极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.化学键的极性越大,键就越强
B.凡能形成氢键的物质,其熔、沸点比同类物质的熔、沸点高
C.CFH3分子中,既有H原子,又有电负性大、半径小的F原子,因此,CFH3分子间可以形成氢键
D.稀有气体能在温度充分降低时液化,而且随相对分子质量的增大熔点升高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列数据是对应物质的熔点:
| Na2O | NaCl | AlF3 | AlCl3 |
| 920 | 801 | 1 291 | 190 |
| BCl3 | Al2O3 | CO2 | SiO2 |
| -107 | 2 073 | -57 | 1 723 |
据此作出的下列判断中错误的是( )
A.铝的化合物的晶体中有的是离子晶体 B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体 D.不同族元素的氧化物可形成相同类型的晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关硫元素及其化合物的说法或描述正确的是( )
A.硫黄矿制备硫酸经历两步:S SO3
SO3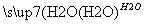 H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2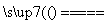 2CO2+2CaSO4
2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com