
下列说法中正确的是()
A. 所有主族元素正化合价数,等于它的族序数
B. ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C. ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
D. 前三周期元素中共有非金属元素12种
考点: 元素周期律和元素周期表的综合应用.
专题: 元素周期律与元素周期表专题.
分析: A、一般来说,主族元素最高正化合价等于其族序数(但F没有正价);
B、同主族元素自上而下,半径增大,得电子能力逐渐减弱;
C、ⅠA、ⅡA族元素的原子失掉最外层电子形成阳离子;
D、对过度元素以外元素,最外层电子数≤该元素原子的电子层数的为非金属(H除外),最外层电子数大于该元素原子的电子层数的为非金属,每周期含有的主族金属元素数目为周期数(第一周期除外),非金属为8﹣周期数(第一周期除外).
解答: 解:A、F没有正价,且有的非金属元素有多种正价,如N有+1、+2、+3、+4、+5价,故A错误;
B、F、Cl、Br、I原子电子层依次增多,半径依次增大,对最外层电子吸引能力逐渐减弱,所以得电子能力逐渐降低,故B正确;
C、H+最外层没有电子,其它ⅠA、ⅡA族元素的阳离子比同周期稀有气体元素的原子的核外电子排布少一个电子层,所以ⅠA、ⅡA族元素的阳离子与上一周期稀有气体元素的原子具有相同的核外电子排布(氢元素除外),故C错误;
D、第一周期有2种,第二周期有8﹣2=6种,第三周期有8﹣3=5种,所以前三周期元素中共有非金属元素2+6+5=13种,故D错误.
故选B.
点评: 本题考查学生元素周期律、周期表知识,可以根据所学知识进行回答,难度不大.注意特殊性,熟练掌握元素周期表.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高.
(1)基态钛原子的核外电子排布式为 .
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于 晶体.
(3)SO42﹣和 S2O82﹣(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是 .
A.SO42﹣中存在σ键和π键且与PO43﹣离子互为等电子体
B.S2O82﹣中存在非极性键且有强氧化性
C.S2O82﹣比SO42﹣稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ,原因是 .
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ,分子的空间构型为 .
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比 .
查看答案和解析>>
科目:高中化学 来源: 题型:
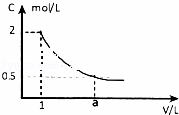
(1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于4.
(2)在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:3Cu+8HN03(稀)═3Cu(NO3)2+2NO↑+4H2O在1.92g Cu中加入100mL稀HNO3溶液,如恰好完全反应,计算生成NO在标准状况下的体积和反应前稀HNO3溶液中溶质的物质的量浓度?(请写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是()
A. 正极附近的SO42﹣离子浓度逐渐增大
B. 正极有O2逸出
C. 电子通过导线由铜片流向锌片
D. 铜片上有H2逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
由铜片、锌片和200mL稀H2SO4组成的原电池中,若锌片发生电化学腐蚀,则当铜片上放出3.36L(标态)气体时,硫酸恰好全部作用完.试计算:
(1)产生这些气体消耗了多少克锌
(2)有多少个电子通过了导线
(3)200mL稀H2SO4的物质的量浓度是多少.
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Cu(NO3)2、Zn(NO3)2、AgNO3各0.1mol的混合溶液中加入0.1molFe粉,充分搅拌后铁溶解,溶液中不在Fe3+离子,同时析出0.1molAg.则下列结论中不正确的是()
A. 氧化性:Ag+>Cu2+>Zn2+
B. 溶液中Cu2+与Fe2+的物质的量之比为1:1
C. Ag+的最先与Fe反应
D. 1molFe可还原1molCu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组只领取下列仪器或用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、火柴、滤纸、漏斗.只应用上述仪器或用品,不能进行的实验操作是()
A. 蒸发 B. 萃取 C. 过滤 D. 蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com