
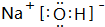 .
.| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH═Na2SO3+2H2O |
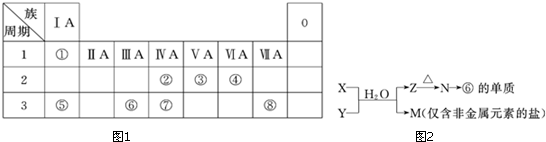
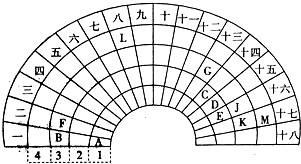
分析 由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)地壳中含量居于第二位的元素为Si;
(2)非金属性越强,最高价含氧酸的酸性越强,同主族电子层越多,原子半径越大,非金属性越弱;
(3)由H、O、Na、Cl中的某些元素可形成既含离子键又含共价键的离子化合物有NaOH、NaClO、Na2O2等;
(4)表中两种元素的原子按1:1组成的常见液态化合物为H2O2,不能做该反应催化剂的物质,能与其(H2O2)发生反应;
(5)W与④是相邻的同主族元素,④是氧元素,故W为硫元素,H2SO3具有酸性、还原性、氧化性;
(6)M是仅含非金属的盐,所以M一定是铵盐,由表中元素组成,可能为NH4Cl或NH4NO3,Z→N→⑥的单质,⑥为Al,推断N是氧化铝,故Z为Al(OH)3.
解答 解:由元素在周期表中的位置可知:①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)地壳中含量居于第二位的元素为Si,处于周期表中第三周期第ⅣA族,
故答案为:第三周期第ⅣA族;
(2)同主族自上而下电子层增大,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,最高价氧化物对应水化物的酸性减弱,
故答案为:同主族自上而下电子层增大,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱;
(3)由H、O、Na、Cl中的某些元素可形成既含离子键又含共价键的离子化合物有NaOH、NaClO、Na2O2等,其中NaOH的电子式为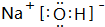 ,
,
故答案为: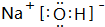 ;
;
(4)表中两种元素的原子按1:1组成的常见液态化合物为H2O2,因为Na2SO3具有还原性,与H2O2发生氧化还原反应,不能作催化剂,
故答案为:c;
(5)W与④是相邻的同主族元素,④是氧元素,故W为硫元素,H2SO3具有酸性、还原性、氧化性,可以被强氧化剂氧化,如H2SO3+Br2+2H2O=H2SO3+2HBr,与NaOH发生中和反应H2SO3+2NaOH=Na2SO3+2H2O,
故答案为:
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH═Na2SO3+2H2O |
点评 本题是考查元素周期表、元素周期律与无机物推断,熟练掌握元素周期表结构,将图中元素序号与周期表对应可以确定每一种元素,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
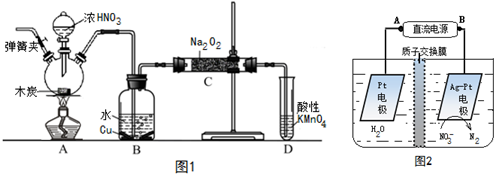
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
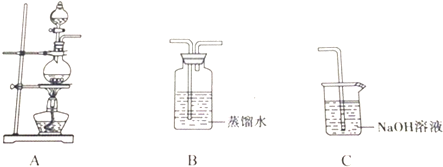
| 实验 | 实验操作 | 现象 | 结论 |
| Ⅰ | 向氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生了一种酸性强于碳酸的物质 |
| Ⅱ | 向品红溶液中滴入氯水 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
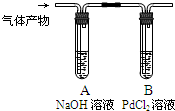 黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为: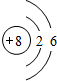 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小:S2->Cl->F->Na+>Al3+ | |
| B. | 热稳定性大小:SiH4<PH3<NH3<H2O<HF | |
| C. | 熔点高低:金刚石>石墨>食盐>干冰>碘晶体 | |
| D. | 沸点高低:NH3>AsH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,用电子式表示FM2的形成过程
,用电子式表示FM2的形成过程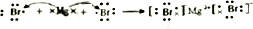 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含离子键的化合物才是离子晶体 | |
| B. | (NH4)2SO4晶体是含有离子建、共价键和配位键的分子晶体 | |
| C. | 由于I-I中的共价键键比F-F、Cl-Cl、Br-Br都弱,因此在卤素单质中I2的熔点、沸点最低 | |
| D. | 分子晶体中一定不存在离子键,而离子晶体中可能存在共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com