
氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。
Ⅰ.实验室模拟工业氨催化氧化法制取硝酸,装置如下图所示。

(1)若分液漏斗中氨水的浓度为9.0mol·L-1,配制该浓度的氨水100mL,用到的玻璃仪器有烧杯、玻璃棒、量筒、 、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的化学式为 。
(3)写出受热时丙装置发生反应的化学方程式 。当戊中观察到石蕊试液变红,则说明已制得硝酸。
Ⅱ.NH3的性质
(4)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),将等浓度、等体积的氨水和硝酸混合,所得溶液中离子浓度从大到小的顺序为 。
(5)已知:氨在纯氧中燃烧生成一种单质和水,利用此原理设计成氨气-氧气燃料电池。在碱性条件下,该电池的负极反应式为 。
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高二上月考三化学试卷(解析版) 题型:推断题
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
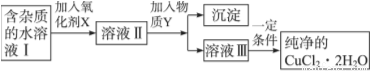
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 4 | 9.0 | 6.7 |
(1) 最适合作氧化剂X的是__________,。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是_______________。
(3)加入的物质Y是___(写化学式),目的是调节溶液的pH。根据信息,溶液的pH范围应为 。
(4)当c(Fe3+)=10-5mol/L时,认为沉淀完全,则Fe(OH)3的Ksp=
(5)结合方程式和必要文字说明解释不能将溶液III直接蒸发结晶得到CuCl2·2H2O晶体的原因_____。
(6)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同 时还产生的现象有_______。
时还产生的现象有_______。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上学期10月月考化学试卷(解析版) 题型:选择题
向足量稀H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1 HCl溶液时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
A.Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-1
C.Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=-18 kJ·mol-1
D.Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=-73 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期第二次模拟测试化学试卷(解析版) 题型:选择题
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示,下列说法不正确的是

A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.图中C点对应溶液体积为48mL
C.原硝酸溶液中含硝酸的物质的量为0.5mol
D.样品中铝粉和铁粉的物质的量之比5:3
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期期中测试化学试卷(解析版) 题型:选择题
等体积等浓度的MOH强碱溶液和HA弱酸溶液混和,溶液中离子浓度关系不正确的是
A.c(M+)=c(HA)+c(A-) B.c(M+)>c(H+)>c(A-)>c(OH-)
C.c(OH-)=c(H+)+ c(HA) D.c(M+)+c(H+) =c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:填空题
如下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH===2K2CO3+6H2O。

(1)甲池是________装置。
(2)乙池中A(石墨)电极的名称是________。
(3)写出通入CH3OH的电极的电极反应式:_________________________。
(4)乙池中反应的化学方程式为______________________________________。
(5)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________ mL(标准状况);此时丙池某电极上析出0.60 g某金属,则丙池中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NACl D.AgNO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高一10月月考化学试卷(解析版) 题型:选择题
下列溶液中,溶质的物质的量浓度为1 mol·L-1 的是
A.将80 g NaOH溶于2 L 水所得的溶液
B.将0.5 mol·L-1的NaNO3溶液100 mL 加热蒸发掉50 g水所得的溶液
C.将40 g NaOH 溶于水并配成1 L的溶液
D.含K+为4 mol·L-1的K2SO4溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高二上期中考试化学试卷(解析版) 题型:实验题
实验室制备1,2-二溴乙烷的反应原理如下:

可能存在的主要副反应有:①乙醇在浓硫酸的存在下在l40℃脱水生成乙醚(CH3CH2OCH2CH3);②浓硫酸将乙醇脱水碳化。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____________;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入____________,其目的是吸收反应中可能生成的酸性气体:(填
正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是_____________________;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用_______________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是____________;但又不能过度冷却(如用冰水),其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省株洲市高三上学期期中化学试卷(解析版) 题型:填空题
普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸张表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散。请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是_____________________________________为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的离子方程式为__________。
(2)为了保护这些纸质文物,有人建议采取如下措施:喷洒Zn(C2H5)2。Zn(C2H5)2可以与水反应生成氧化锌和乙烷,生成的氧化锌可以防止酸性腐蚀。用该方法生成氧化锌的化学方程式为__________________。
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾。钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
① FeTiO3+ C+ Cl2 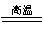 TiCl4+ FeCl3+ CO
TiCl4+ FeCl3+ CO
② TiCl4+O2 TiO2+2Cl2
TiO2+2Cl2
(4)某新型“纸电池”以碳纳米管和金属锂为两极,造纸用的纤维素在一种离子液体M中溶解作隔离膜,电池工作时的总反应式为xLi+C(碳纳米管)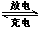 LixC,下列有关说法正确的是
LixC,下列有关说法正确的是
A.放电时Li+由正极向负极移动
 B.充电池的阳极反应式为LixC-xe-= xLi++ C
B.充电池的阳极反应式为LixC-xe-= xLi++ C
C.M可能为羧酸、醇等含活泼氢的有机物
D.锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com