
| A. | 用量筒量取10.00 mL 1.0mol•L-1的盐酸于100mL容量瓶中,加水定容至刻度,可配得0.1mol•L-1的盐酸 | |
| B. | 做焰色反应时,若连续做两个样品,应将铂丝用硫酸洗净并灼烧到无色 | |
| C. | 取试样与氢氧化钠浓溶液共热,产生能使湿润红色石蕊试纸变蓝色的气体,则说明试样中有NH4+ | |
| D. | 直接用分液的方法分离乙酸和乙酸乙酯 |
分析 A.容量瓶能配制一定物质的量浓度溶液,但不能稀释或溶解药品;
B.做焰色反应时用盐酸洗涤铂丝;
C.铵根离子和NaOH混合并加热时生成氨气,氨气能使湿润的红色石蕊试纸变蓝色;
D.互溶的液体采用蒸馏方法分离,互不相溶的液体采用分液方法分离.
解答 解:A.容量瓶能配制一定物质的量浓度溶液,但不能稀释或溶解药品,应该用量筒量取10.0 mL 1.0mol•L-1的盐酸于烧杯中,加水稀释,冷却至室温后,转移到容量瓶中配制溶液,故A错误;
B.做焰色反应时用盐酸洗涤铂丝,氯化物熔点较低,加热能除掉,但硫酸盐灼烧时不能除掉,故B错误;
C.铵根离子和NaOH混合并加热时生成氨气,氨气能使湿润的红色石蕊试纸变蓝色,所以取试样与氢氧化钠浓溶液共热,产生能使湿润红色石蕊试纸变蓝色的气体,则说明试样中有NH4+,故C正确;
D.互溶的液体采用蒸馏方法分离,互不相溶的液体采用分液方法分离,乙酸和乙酸乙酯互溶,应该采用蒸馏方法分离,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、物质分离和提纯、溶液配制、焰色反应等知识点,明确实验原理及基本操作方法、物质性质与物质分离方法关系是解本题关键,知道常见离子检验方法和现象,易错选项是D.


科目:高中化学 来源: 题型:解答题
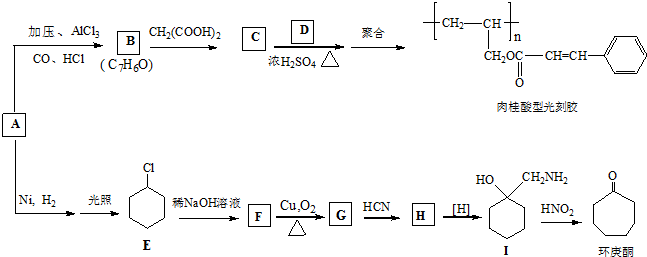
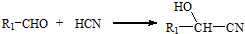
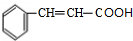 、CH2=CHCH2OH.
、CH2=CHCH2OH.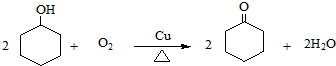 .
.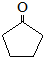 (环戊酮)为起始原料制备
(环戊酮)为起始原料制备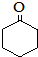 (环己酮)的合成路线.
(环己酮)的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
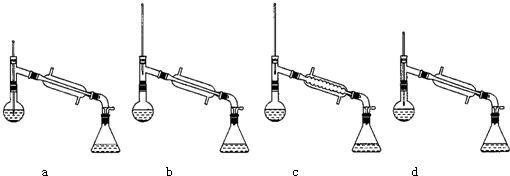
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油生产汽油的过程中没有发生化学变化 | |
| B. | 氮的固定过程中氮元素被氧化 | |
| C. | 葡糖糖转变成酒精的过程中产生的是水解反应 | |
| D. | 鸡蛋被煮熟的过程中发生的是蛋白质的变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
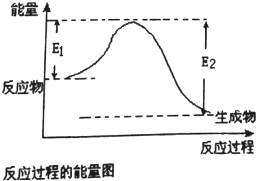 已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题:
已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题: ,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.
,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com