
| A、pH=7的溶液中:K+、Fe3+、Cl-、NO32- |
| B、强酸性溶液中:Cu2+、ClO-、Cl-、Ba2+ |
| C、0.1mol?L-1 的NaHCO3溶液中:K+、Al3+、Fe3+、NO3- |
| D、由水电离出的c(H+)=10-13mol?L-1的溶液中:Al3+、K+、NO3-、SO42- |


科目:高中化学 来源: 题型:
| A、原子半径:A<B<C |
| B、A的氢化物稳定性大于C的氢化物稳定性 |
| C、三种元素的最高价氧化物对应水化物均可由化合反应得到 |
| D、高温下,A单质能置换出C单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的
如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的| 1 |
| 4 |
| A、2:7 | B、5:4 |
| C、2:1 | D、7:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
| A、电池放电时通入空气的电极为负极 | ||
| B、电池放电时负极的电极反应式为CH3OH-6e-+H2O═CO2↑+6H+ | ||
C、由于CO
| ||
| D、电池放电时每消耗1 mol CH3OH转移6 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
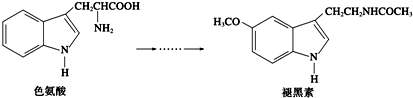
| A、色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点 |
| B、在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出 |
| C、在一定条件下,色氨酸可发生加聚反应 |
| D、褪黑素与色氨酸结构相似,也具有两性化合物的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “钠-硫”原电池具有输出功率较高.循环寿命长等优点,其工作原理可表示为:2Na+xS
“钠-硫”原电池具有输出功率较高.循环寿命长等优点,其工作原理可表示为:2Na+xS| 放电 |
| 充电 |
| A、这是一种新型无机非金属材料 |
| B、此化合物可能发生加成反应 |
C、原电池的负极反应将是单体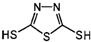 转化为 转化为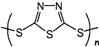 的过程 的过程 |
| D、当电路中转移0.02 mol电子时,将消耗原电池的正极反应材料1.48 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,稀释0.1mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |
| B、常温下,某醋酸溶液的pH=3,将此溶液稀释10倍后,溶液的pH=4 |
| C、常温下,可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力 |
| D、常温下,pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)>c(NaHCO3)>c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用碳酸钠晶体配制1.00mol?L-1的Na2CO3溶液100mL,完成下列问题:
实验室用碳酸钠晶体配制1.00mol?L-1的Na2CO3溶液100mL,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol的2H35Cl分子中的中子数是2NA |
| B、将2.24L(标准状况下)CO2通入1L 0.15mol?L-1的NaOH溶液中,所得CO32-和HCO3-数目均为0.05NA |
| C、铁作电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) |
| D、标准状况下,一定量的铜与硝酸反应后生成22.4L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com