在实验室中拟用氧化铜、稀硫酸和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案;

甲:①把CuO溶于适量稀硫酸中;②在①的溶液中加入适量Zn,充分反应后过滤、烘干,即得纯净的Cu.
乙:①锌与稀H
2SO
4反应制H
2;②将H
2通入CuO中并加热,充分反应后即得纯净的Cu.
(1)若要制得相同质量的纯Cu,所消耗的锌和稀硫酸的量:甲
小于
小于
乙(填“大于”、“小于”或“等于”),原因是
乙方案中氢气除了作还原剂外,还需用来排尽装置中的空气和作保护气
乙方案中氢气除了作还原剂外,还需用来排尽装置中的空气和作保护气
.
(2)乙用上图装置来制取干燥的H
2,a中的液体应是
稀硫酸
稀硫酸
;b中的液体应是
浓硫酸
浓硫酸
,使该装置产生氢气的操作顺序应该是
打开止水夹①②③,由④通入少量气体使稀硫酸流入盛锌的容器内,再立即关闭
打开止水夹①②③,由④通入少量气体使稀硫酸流入盛锌的容器内,再立即关闭
.d的优点
防止不纯的氢气点燃时发生爆炸
防止不纯的氢气点燃时发生爆炸
.
(3)丙同学认为上述两种方案所制得的Cu都难以保证Cu的纯度,应对上述两种方案加以完善.你
是
是
(填“是”或“否”)赞同丙同学的看法.
理由:①(对甲同学实验而言)
甲方案制得的铜中可能混有锌,且过滤后未洗涤
甲方案制得的铜中可能混有锌,且过滤后未洗涤
;
②(对乙同学实验而言)
乙方案制得的铜中可能混有氧化铜
乙方案制得的铜中可能混有氧化铜
.
(4)请你分别对甲、乙两同学的实验方案加以完善:
①(甲)
将甲过滤所得的固体加入过量的稀硫酸,不断搅拌,至不再放出气体为止,过滤并洗涤、烘干
将甲过滤所得的固体加入过量的稀硫酸,不断搅拌,至不再放出气体为止,过滤并洗涤、烘干
.
②(乙)
将乙所得的固体加入过量的稀硫酸,不断搅拌,充分反应后过滤并洗涤、烘干
将乙所得的固体加入过量的稀硫酸,不断搅拌,充分反应后过滤并洗涤、烘干
.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
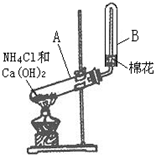 某同学在实验室制取氨气的实验装置如图所示.请回答:
某同学在实验室制取氨气的实验装置如图所示.请回答: