
| A、1:1 | B、4:3 | C、3:4 | D、8:9 |
| 8 |
| 3 |
| 8 |
| 3 |
| 9 |
| 8 |
| 3 |
| 2 |
| 9 |
| 8 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:

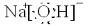
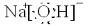
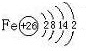
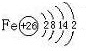
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:江苏省海安县南莫中学2011届高三上学期期中化学试题 题型:022
钛被认为是21世纪的重要金属材料.纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.
Ⅰ.目前大规模生产钛的方法是:
第一步 首先将金红石(TiO2)、炭粉混合,在高温条件下通入氯气制得TiCl4;
第二步 在氮气氛围中用过量的镁在加热条件下与TiCl4反应制得金属钛.
已知:①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)
ΔH=-566 kJ·mol-1③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则
:TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=________.Ⅱ.
纳米TiO2可通过TiCl4水解制备,过程为:在冰水浴强力搅拌下,将一定量的TiCl4滴加到溶有HCl和(NH4)2SO4的冰的TiCl4水溶液中,控制TiCl4浓度为1.1 mol/L时撤去冰浴,逐步升温到95℃,恒温水解1h后,滴加氨水,调节溶液pH约为6,自然冷却后过滤,产物经水洗至无Cl-和SO42-后,再用乙醇洗涤3遍,高温煅烧2h制备纳米TiO2.(1) TiCl4水解生成TiO2·x H2O的化学方程式为________.
(2)简述升温和调节溶液pH的目的:________.
Ⅲ.在制造TiO2过程中,需要测定Ti(Ⅳ)的含量.测定时首先将TiO2溶解为钛液,然后取10 mL用水冲稀10倍,加过量铝粉,充分振荡,使其完全反应:
Ti(Ⅳ)+Al→Ti3++Al3+.过滤后,取出滤液20 mL,向其中滴加2~3滴KSCN溶液,再加5 mL蒸馏水振荡,用酸式滴定管滴加0.1 mol/L FeCl3溶液,终点到来时,用去了30 mL的FeCl3溶液.
(1)滴定终点的现象是________.
(2)原钛液的物质的量浓度为________.
(3)若在滴定终点读取滴定管刻度时,俯视标准液液面,则使Ti(Ⅳ)的含量测定结果________(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
信息、材料、能源被称为新科技革命的“三大支柱”。其中无机非金属材料科学的发展和新型材料的实际应用能大大推动人类社会生活、科技和社会经济的发展。
⑴高温金属陶瓷广泛应用于火箭和导弹技术中。将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面,在高温下煅烧:4Al + 3TiO2 + 3C![]() 2Al2O3 + 3TiC,留在金属表面的涂层是一种高温金属陶瓷。下列有关该反应说法正确的是
2Al2O3 + 3TiC,留在金属表面的涂层是一种高温金属陶瓷。下列有关该反应说法正确的是
A.TiO2是氧化剂,C、Al 是还原剂 B.TiC中钛元素为-4价
C.TiC不属于新型无机非金属材料 D.每生成1mol TiC转移电子4mol
⑵硅酸盐的成分较复杂,常改写成氧化物的形式(改写时注意金属氧化物写在前,非金属氧化物写在后,低价在前,高价在后,H2O一般写在最后)。
①将下列硅酸盐改写成氧化物的形式:镁橄榄石(Mg2SiO4)_______,②高岭石[(Al2(Si2O5)(OH)4]_____。
②许多含氧酸及其盐类均可以类似地改写为氧化物形式,请继续改写以下物质: HNO3______;HCOOH________;KAl(SO4)2?12H2O_________。通过以上改写可知,HNO3的酸酐为________,HCOOH与浓硫酸反应可制得________气体。
③已知在一定条件下,Fe在Cl2中燃烧可以生成Fe3Cl8,它可以看作是FeCl2?2FeCl3,类似地,碘与铁在一定条件下可得到Fe3I8,则它可以看作是__________。
⑶请指出在建筑行业中出现的“豆腐渣”工程可能的因素。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(10分)钛被认为是21世纪的重要金属材料。纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
Ⅰ.目前大规模生产钛的方法是:第一步 首先将金红石(TiO2)、炭粉混合,在高温条件下通入氯气制得TiCl4;第二步 在氮气氛围中用过量的镁在加热条件下与TiCl4反应制得金属钛。
已知:① C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 ② 2CO(g)+O2(g)=2CO2(g)
△H=-566kJ·mol-1 ③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ·mol-1
则:TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
Ⅱ.纳米TiO2可通过TiCl4水解制备,过程为:在冰水浴强力搅拌下,将一定量的TiCl4滴加到溶有HCl和(NH4)2SO4的冰的TiCl4水溶液中,控制TiCl4浓度为1.1mol/L时撤去冰浴,逐步升温到95℃,恒温水解1h后,滴加氨水,调节溶液pH约为6,自然冷却后过滤,产物经水洗至无Cl-和SO42-后,再用乙醇洗涤3遍,高温煅烧2h制备纳米TiO2。⑴TiCl4水解生成TiO2·x H2O的化学方程式为_____________________。
⑵简述升温和调节溶液pH的目的: 。
Ⅲ.在制造TiO2过程中,需要测定Ti(Ⅳ)的含量。测定时首先将TiO2溶解为钛液,然后取10mL用水冲稀10倍,加过量铝粉,充分振荡,使其完全反应:
Ti(Ⅳ)+Al→Ti3++Al3+。过滤后,取出滤液20mL,向其中滴加2~3滴KSCN溶液,再加5 mL蒸馏水振荡,用酸式滴定管滴加0.1mol/L FeCl3溶液,终点到来时,用去了30mL的FeCl3溶液。⑴滴定终点的现象是____________________________________。[来
⑵原钛液的物质的量浓度为 。
⑶若在滴定终点读取滴定管刻度时,俯视标准液液面,则使Ti(Ⅳ)的含量测定结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com