
分析 (1)根据m=nM计算质量之比,根据N=nNA计算分子数目之比,结合分子式计算原子数目、H原子数目之比;
(2)根据m=nM计算二氧化碳的质量,根据N=nNA计算二氧化碳分子数目,根据V=nVm计算二氧化碳的体积,氧原子物质的量为二氧化碳的2倍;
(3)根据m=nM计算质量之比,根据N=nNA计算分子数目之比,结合分子式计算原子数目之比,根据V=nVm计算体积之比.
解答 解:(1)根据m=nM可知,等物质的量的CH4和NH3的质量比为16g/mol:17g/mol=16:17,根据N=nNA可知,二者分子个数比为1:1,由分子式可知,原子个数比为1×5:1×4=5:4,氢原子个数比为1×4:1×3=4:3,
故答案为:16:17;1:1;5:4;4:3;
(2)2mol CO2的质量为2mol×44g/mol=88g,含分子数约为2mol×6.02×1023mol-1=1.204×1024,在标准状况下所占有的体积约为2mol×22.4L/mol=44.8L,含氧原子的物质的量为2mol×2=4mol,
故答案为:88;1.204×1024;44.8;4;
(3)0.3mol的氧气和0.2mol的臭氧O3,它们的质量之比是0.3mol×32g/mol:0.2mol×48g/mol=1:1,含有分子数之比是0.3mol:0.2mol=3:2,原子数之比是3×2:2×3=1:1,它们的体积比(同温、同压)是0.3mol:0.2mol=3:2,
故答案为:1:1;3:2;1:1;3:2.
点评 本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
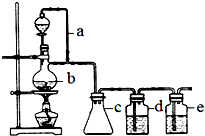 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
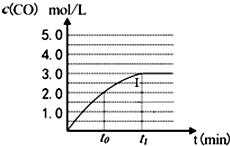 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| B. | 氯气与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 钠和冷水反应:Na+2H2O═Na++2OH?+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤代反应 | B. | 加聚反应 | C. | 酯化反应 | D. | 消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
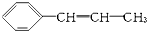 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为 | |
| D. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
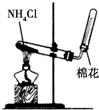 |  | 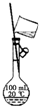 | 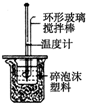 |
| A.实验室制取氨气 | B.测定反应速率装置 | C.配制100 mL 0.1 mol/L盐酸 | D.测定中和反应的反应热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫完全燃烧生成二氧化硫时,放出的热量为硫的标准燃烧热 | |
| B. | 在101kPa时,1mol碳燃烧所放出的热量为碳的标准燃烧热 | |
| C. | 在101kPa时,由2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,可知CO的标准燃烧热为283 kJ•mol-1 | |
| D. | 乙炔的标准燃烧热为1299.6 kJ•mol-1,则2CH2(g)+5O2(g)═4CO2(g)+2H2O(g)反应的△H=-2 599.2 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com