
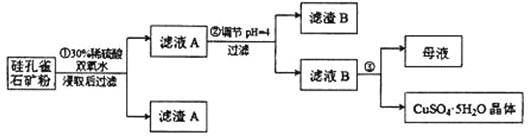
【题目】硅孔雀石是一种含铜的矿石,含铜形态为 CuCO3·Cu(OH)2 和 CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如图所示:
请回答下列问题;
(1)步骤①过滤所需的玻璃仪器包括烧杯、______________________。
(2)写出步骤①中在矿粉中加入30%稀硫酸时,CuSiO3·2H2O 发生反应的方程式:_______________________________________。
(3)步骤①中加入双氧水的作用是_____________________________(用离子方程式表示)
(4)步骤②中调节溶液的pH约为4,可以达到除去Fe3+而不损失CuSO4的目的,调节溶液pH可以选用的最佳试剂是_____________
A.Cu(OH)2 B.NH3·H2O C.CuO D.NaOH
(5)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH时,所得滤渣B的成分的化学式为______________
(6)步骤③将滤液B通过加热浓缩、__________、过滤等操作可得到硫酸铜晶体。
【答案】 漏斗和玻璃棒 CuSiO3·2H2O+H2SO4=CuSO4+ H2SiO3+2 H2O 2Fe2+ + H2O2+2H+ = 2Fe3++2H2O AC Fe(OH)3、Al(OH)3 冷却结晶
【解析】试题分析:由制备实验流程可知,Cu2(OH)2CO3、FeCO3、Fe2O3、Al2O3均与硫酸反应生成相应的硫酸盐,CuSiO3·2H2O与硫酸反应生成硫酸铜、硅酸沉淀,只有SiO2不反应,则滤渣a为SiO2、H2SiO3,双氧水具有氧化性将亚铁离子氧化为铁离子,所以溶液a含Cu2+、Fe3+、Al3+,体积PH=4促进Fe3+完全水解转化为沉淀,所以滤液B中主要为硫酸铜,蒸发浓缩、冷却结晶得到CuSO4![]() 5H2O。
5H2O。
解析:根据以上分析,(1)过滤所需的玻璃仪器包括烧杯、漏斗和玻璃棒。
(2)稀硫酸与CuSiO3·2H2O 发生反应生成硫酸铜、硅酸、水,方程式是CuSiO3·2H2O+H2SO4=CuSO4+ H2SiO3+2 H2O。
(3)双氧水具有氧化性将亚铁离子氧化为铁离子,离子方程式是2Fe2+ + H2O2+2H+ = 2Fe3++2H2O;
(4)步骤②中调节溶液的pH约为4,可以达到除去Fe3+而不损失CuSO4的目的,为不引入新杂质,调节溶液pH可以选用的最佳试剂是Cu(OH)2、CuO,故选AC;
(5)根据氢氧化物开始沉淀和完全沉淀的pH,调节pH=4时,Fe3+完全水解、Al3+部分水解,所以得到滤渣B的成分的化学式为Fe(OH)3、Al(OH)3;(6)滤液B中主要为硫酸铜,蒸发浓缩、冷却结晶、过滤,得到CuSO4![]() 5H2O。
5H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
B. 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA
C. 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子数为0.4 NA
D. 常温下56 g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体中水的含量约占65%,下列选项中能正确说明水对人体重要性的是 ( )
①水和糖类、蛋白质、脂肪一样,为人体提供能量
②没有水,人体内大部分化学反应就根本不会发生
③水的比热容小,有利于维持体温
④体内营养物质的运输离不开水
A. ①② B. ②③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液溶质物质的量浓度为1 mol/L
C.0.5 L 2 molL﹣1的BaCl2溶液中,Ba2+和Cl﹣的总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 gcm﹣3)与10 mL18.4 molL﹣1的硫酸的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 △H=+88.6kJ/mol
△H=+88.6kJ/mol
则M与N相比,较稳定的是____。
(2)已知CH3OH⑴的燃烧热为726.5kJ·mol-1,CH3OH(l) + l/2O2(g)=CO2(g)+2H2(g)
△H=-akJ·mol-1,则a_______726.5 (填“>”、“<”或 “=”)
(3)将Cl2和H2O(g)通过灼热的木炭层,生成HCl和CO2。当有1mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:______________________ 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料, 4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ·mol-1,则27g铝粉完全反应放出的热量为_____________。
(5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ mol-1
CO(g)+l/2O2(g)=CO2(g) △H=-283. 0kJ mol-1
C (石墨)+O2(g)=CO2(g) △H=-393.5kJ mol-1
则4Fe (s)+3O2(g) =2Fe2O3 (s) △H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO-的浓度存在关系式c(HCOO-)+c(HCOOH)=0.100 mol/L,含碳元素的粒子的浓度与pH的关系如图所示。下列说法正确的是

A. 298K时,加蒸溜水稀释P点溶液,溶液中n(H+)·n(OH-)保持不变
B. 0.1 mol/L HCOONa溶液中有c(HCOO-)+c(OH-)=c(H+)+c(HCOOH)
C. 298K时,HCOOH的电离常数Ka=1.0×10-3.75
D. 0.1 mol/L HCOONa溶液和0.1 mol/L HCOOH溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一。
(l)三氟化氮可由氨气和氟气反应得到: 4NH3+3F2=NF3+3NH4F。NH3的电子式为__________,反应中氨气显示的化学性质有______________,当有17.0 g氨气发生反应时,转移电子的物质的量为_____。
(2)在潮湿的空气中,NF3能与水蒸气发生反应,产物有HF、NO和一种酸,则被氧化与被还原元素原子的物质的量之比为_________,NF3、F2、NO三种气体氧化性由弱到强的顺序为_________。
(3)三氟化氮在空气中泄露时,很易被发现,依据的现象是______________________。
(4)NCl3结构类似NF3,但NCl3中N元素显-3价,NCl3遇水发生反应,目反应为非氧化还原反应,该反应的化学方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com