
【题目】法医常用马氏试砷法检验是否砒霜(As2O3)中毒,涉及的反应如下:
Ⅰ: 6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷) ↑+3H2O
Ⅱ: 2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布式__________
(2)砷烷的空间结构为_________;砷烷中心原子杂化方式为________
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3![]() AsH3
AsH3![]() SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
(4)第一电离能数据I(As)____ I(Se)
(5)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图所示。
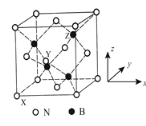
晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d gcm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可)
【答案】4S24P5 三角锥形 sp3杂化 对于分子组成结构相似的物质来说,随相对分子质量增加,分子间作用力增大,故熔沸点升高 NH3可以形成分子间氢键 > (3/4,3/4,3/4) ![]()
【解析】
(1)As位于周期表中第4周期,第VA族,其价电子排布式为4S24P5 ;
(2)砷烷为AsH3,根据VSEPR理论和杂化轨道理论判断分子的空间构型和中心原子的杂化方式;
(3)从PH3→AsH3→SbH3,熔沸点依次升高,P、As、Sb均为氮族元素,三者均为分子晶体,随着相对分子质量增加,分子间作用力增大,熔沸点升高,NH3分子由于形成分子间氢键,沸点异常升高;
(4)第一电离能,同周期主族元素,随着原子序数的增加,呈现增大的趋势,但VA族大于相邻主族元素,是由于VA族元素的原子结构是半充满的,较稳定;
(5)由X、Y的参数,可知X处于坐标系原点,x、z轴形成平面为晶胞前平面,x、y轴构成的平面为晶胞下底面,z、y轴构成的平面为晶胞左侧平面,Y处于晶胞的前平面面心位置。Z与周围4个N原子形成正四面体,Z与顶点N原子连线处于晶胞体对角线上,且二者距离为体对角线的1/4,则Z与X的距离为晶胞体对角线长度的3/4,Z到坐标系的3个平面距离均为晶胞棱长的3/4.均摊法计算晶胞中个原子数目,再计算晶胞中各原子总质量,而原子总质量也等于晶体密度与晶胞体积的乘积。
(1)As位于周期表中第4周期,第VA族,其价电子排布式为4S24P5 ;
(2)砷烷为AsH3,根据VSEPR理论,中心As原子的配位原子数为BP=3,孤电子对数为LP=(5-1×3)/2=1,则价电子对数为VP=BP+LP=3+1=4,根据杂化轨道理论,中心As原子为sp3杂化,由于存在一对孤电子对,占据正四面体型的顶点,则砷烷的空间构型为三角锥形;
(3)从PH3→AsH3→SbH3,熔沸点依次升高,P、As、Sb均为氮族元素,三者均为分子晶体,随着相对分子质量增加,分子间作用力增大,熔沸点升高,NH3分子由于形成分子间氢键,沸点异常升高,因此从PH3→AsH3→SbH3,熔沸点依次升高的原因是:对于分子组成结构相似的物质来说,随相对分子质量增加,分子间作用力增大,故熔沸点升高,NH3分子例外的原因是:NH3可以形成分子间氢键;
(4)第一电离能,同周期主族元素,随着原子序数的增加,呈现增大的趋势,但VA族大于相邻主族元素,是由于VA族元素的原子结构是半充满的,较稳定,因此第一电离能数据I(As)>I(Se);
(5)由X、Y的参数,可知X处于坐标系原点,x、z轴形成平面为晶胞前平面,x、y轴构成的平面为晶胞下底面,z、y轴构成的平面为晶胞左侧平面,Y处于晶胞的前平面面心位置。Z与周围4个N原子形成正四面体,Z与顶点N原子连线处于晶胞体对角线上,且二者距离为体对角线的1/4,则Z与X的距离为晶胞体对角线长度的3/4,Z到坐标系的3个平面距离均为晶胞棱长的3/4.由Y的参数可知晶胞棱长为1,Z到坐标系平面距离均为3/4,故Z的参数为:(3/4,3/4,3/4),晶胞中B原子数目=4、N原子数目=8×1/8+6×1/2=4,晶胞中原子总质量=(4×14+4×11)/NAg=d g·cm-3×(a×10-7 cm)3,解得a=![]()


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在容积固定的VL密闭容器中充入4molNH3和5molO2,发生如下反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)。请回答下列问题:
4NO(g)+6H2O(g)。请回答下列问题:
(1)下列能说明该反应已经达到平衡状态的是_______;
A .容器中气体总质量不变
B. c(O2)不变
C. υ(O2)=1.25υ(NH3)
D. 体系压强不变
E. 相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)已知上述反应达到平衡后,该反应各物质的浓度的定量关系称之为K,其表达式可表示为K =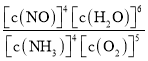 。如果达到平衡时,NH3的转化率为a,则K=_____(用含a的式子表示,数字采用指数形式)。
。如果达到平衡时,NH3的转化率为a,则K=_____(用含a的式子表示,数字采用指数形式)。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小。则速率逐渐增大是因为______,速率又逐渐减小的原因是_____。
(4)1mol NH3(g)在纯氧中完全燃烧生成无污染的气态物质,放出akJ的热量。写出该反应的热化学方程式_____。
(5)若将(4)所述反应设计为原电池,负极反应式 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,已知:NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl,其一种生产工艺如下。
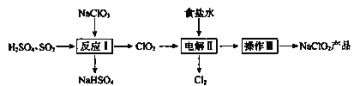
请回答下列问题:
(1)NaClO2中Cl元素的化合价为____________。
(2)反应I:
①SO2做___________(填“氧化剂”或“还原剂”)。
②写出反应I的化学方程式:__________________________。
(3)电解II:
①所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的Mg2+和Ca2+,需要加入的试剂分别为_______、______。
②电解过程中被氧化的物质是________。
③可用NaOH溶液吸收电解产生的Cl2,反应的离子方程式是______________。
(4)操作III:
滤液获利NaClO2的操作步骤:①加热蒸发;②趁热过滤;③洗涤;④干燥,得到成品。趁热过滤应控制的温度范围是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国最新战机歼-31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应:TiCl4+2Mg==Ti+2MgCl2,下列有关该反应的说法正确的是()

A. TiCl4是还原剂
B. Mg得到电子
C. TiCl4发生氧化反应
D. Mg被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
以苯和乙炔为原料合成化工原料E的路线如下:
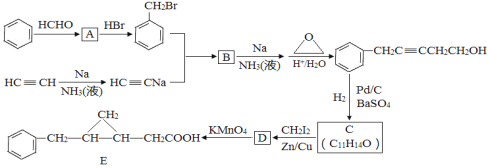
回答下列问题:
(1)A的名称___________________。
(2)生成B的化学方程式为____________________________,反应类型是________。
(3)C的结构简式为____________,C的分子中一定共面的碳原子最多有_____个。
(4)与D同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有______种,请任写两种同分异构体的结构简式:_____________________________。
(5)参照上述合成路线,设计一条以乙炔和必要试剂合成环丙烷的路线:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C. Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D. P-P键的键能为(5a-3b+12c)/8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的碳酸钠溶液;②加入稍过量的氢氧化钠溶液;③加入稍过量的氯化钡溶液;④滴入稀盐酸至无气泡产生;⑤过滤;正确的操作顺序是
A.③②⑤①④B.①②③⑤④C.②③①⑤④D.③⑤②①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com