
通常把原子总数和价电子总数相同的分子或离子称为等电子体.人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A.CH4和NH4+是等电子体,键角均为60°
B.NO3﹣和CO32﹣是等电子体,均为平面正三角形结构
C.H3O+和PCl3是等电子体,均为三角锥形结构
D.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
科目:高中化学 来源:2015-2016学年山东省高二下学期六月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.向滴有酚酞的水中加入过量Na2O2粉末并振荡,溶液由无色变红又变无色
B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C.将一小粒金属钠投入水和苯的混合体系中,钠在苯与水的界面处反应并可能作上、下跳动
D.某物质灼烧时,焰色反应为黄色,该物质一定只含钠元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省成都市高二下4月月考化学试卷(解析版) 题型:填空题
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
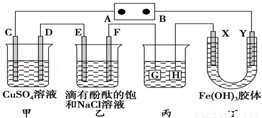
请回答:
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色
逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向
Y极移动.
(2)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液
是 溶液.当乙中溶液的pH是13时(此时乙溶液体积为500mL),甲中溶液的pH (填“变大”、“变小”或“不变”),丙中镀件上析出银的质量为 .
(3)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 .
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是
(5)用甲装置电解100毫升0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl的混合液,若在一极析出19.2gCu,在另一极产生的气体在标况下的体积为 L.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省成都市高二下4月月考化学试卷(解析版) 题型:选择题
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加几滴石蕊溶液.下列实验现象中正确的是( )
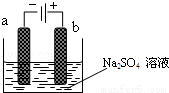
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附中高二下3月月考化学试卷(解析版) 题型:填空题
通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
化学键 | Si﹣O | Si﹣Cl | H﹣H | H﹣Cl | Si﹣Si | Si﹣C |
键能/kJ•mol﹣1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列物质的熔点高低(填“>”或“<”):SiCl4 SiO2,原因是 .
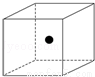
(2)图中立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)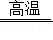 Si(s)+4HCl(g);
Si(s)+4HCl(g);
1mol晶体硅中含 molSi﹣Si键;该反应的反应热△H= kJ•mol﹣1.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附中高二下3月月考化学试卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.离子化合物中一定不含非极性共价键
B.原子晶体的熔点一定高于其他晶体
C.金属晶体的堆积方式的空间利用率最低的是Po
D.构成晶体的粒子一定含有化学键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附中高二下3月月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.钾(K)原子基态的原子结构示意图为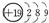
B.Ca2+电子排布式为1s22s22p63s23p64s2
C.原子核内有10个中子的氧原子可表示为 O
O
D.H2O分子的电子式为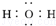
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西重点中学协作体高二下学期期末化学试卷(解析版) 题型:选择题
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
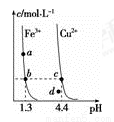
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.在b、c两点代表的溶液中Fe(OH)3、Cu(OH)2分别达到饱和
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(新课标3卷精编版) 题型:填空题
[化学——选修3:物质结构与性质]砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
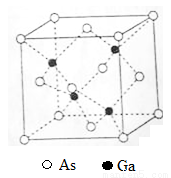
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com