

 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大.
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、发生化学反应时失去电子越多的金属原子,还原能力越强 |
| B、金属阳离子被还原后,不一定得到该元素的单质 |
| C、核外电子总数相同的粒子,一定是同种元素的原子 |
| D、只能与酸反应的氧化物,一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
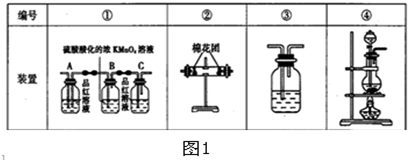
| 实验操作 | 预期现象 | 结论 | |
| 验证猜想Ⅰ | 含有Fe2+和Fe3+ | ||
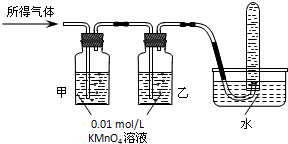
| 验证猜想Ⅱ | 将所得气体通入如图2所示装置 | 含有两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
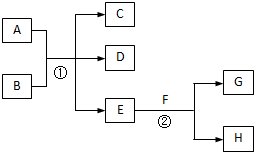 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com