
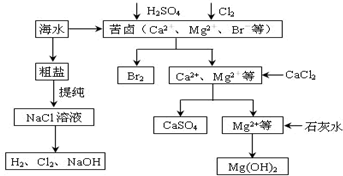
分析 (1)根据题意可知,当Fe2+以Fe(OH)2的形式完全沉淀时,Cu2+已经沉淀完毕,所以除去亚铁离子时不能除去铜离子,则应该调节溶液pH且将亚铁离子转化为铁离子;
(2)亚铁离子具有还原性、次氯酸根离子具有氧化性,二者发生氧化还原反应生成铁离子和氯离子,铁离子和次氯酸根离子能发生双水解反应;
(3)在调整pH的同时应不带入新的杂质离子,加入的固体要和氢离子反应;
(4)当c(Cu2+)为1 mol/L时,代入关系式lg c(Cu2+)=8.6-2pH,可解得pH=4.3,再结合铁离子和pH关系判断铁离子是否完全沉淀.
解答 解:(1)根据题意可知,当Fe2+以Fe(OH)2的形式完全沉淀时,Cu2+已经沉淀完毕,因此欲除去Fe2+,应先将Fe2+氧化成Fe3+,再调节溶液的pH在3~4之间,所以其采用的方法是:先将Fe2+氧化成Fe3+,再调节溶液的pH在3~4之间,
故答案为:先将Fe2+氧化成Fe3+,再调节溶液的pH在3~4之间;
(2)根据题意当氧化剂选用NaClO时,NaClO先将Fe2+氧化,次氯酸根离子和Fe3+发生双水解反应,其反应的离子方程式可表示为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO,很显然,随着反应的进行,氢离子浓度降低,则溶液的pH增大,Fe3+同样开始沉淀,
故答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO;增大;
(3)在调整pH的同时应不带入新的杂质离子,因此可选用难溶于水的氧化铜或氢氧化铜等固体,
故答案为:CuO或Cu(OH)2;
(4)当c(Cu2+)为1 mol/L时,代入关系式lg c(Cu2+)=8.6-2pH,可解得pH=4.3,此时溶液中的Fe3+能沉淀完全,
故答案为:4.3;能.
点评 本题考查物质分离、提纯的综合应用,明确物质性质是解本题关键,侧重考查学生获取信息利用信息解答问题能力,注意除杂时不能引进新的杂质,注意亚铁离子除去方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa )>c(NaOH ) | |
| C. | NH4HSO4溶液中滴加NaOH溶液至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
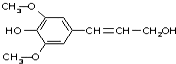 膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇能发生的反应类型有氧化、取代、水解、加聚 | |
| B. | 芥子醇的分子式是C11H14O4,属于芳香烃 | |
| C. | 芥子醇分子中所有碳原子可能在同一平面 | |
| D. | 芥子醇能与3mol溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
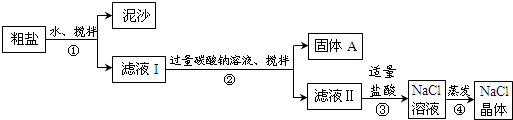
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ①有气泡冒出且澄清石灰水变浑浊 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入②稀盐酸或稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ③猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, ④加入硝酸酸化的硝酸钡溶液 | ⑤产生不溶于稀硝酸的白色沉淀 | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 mol•L-1的KClO3溶液中,K+的个数为NA | |
| B. | 在标准状况下,22.4 L CH3CH2OH的分子数为NA | |
| C. | 32 g氧气和臭氧的混和气体中含有的氧原子数为2NA | |
| D. | 22.4 L HCl气体中含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的电子式为 H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔的结构简式(删:可以)写成 CHCH | |
| C. | 镁的原子结构示意图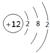 | |
| D. | 碳酸氢钠溶于水电离方程式:NaHCO3═Na++H++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com