
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| CO | H2O | CO2 | H2 | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| C. | 容器①中CO反应速率等于H2O的反应速率 | |
| D. | 平衡时,两容器中CO2的浓度相等 |
分析 A.根据放出的热量计算参加反应CO的物质的量,进而计算CO的转化率;
B.容器①②温度相同,同一可逆反应正逆平衡常数互为倒数,根据容器①计算平衡常数,令容器②中CO2的物质的量变化量为amol,表示出平衡时各组分的物质的量,反应前后气体的体积不变,利用物质的量代替浓度代入平衡常数表达式计算a的值,进而计算CO2的转化率,
C.速率之比等于化学计量数之比;
D.根据A、B的计算可知平衡时①、②中二氧化碳的物质的量,容器体积相等,若物质的量相等,则平衡时二氧化碳的浓度相等.
解答 解:A.平衡时放出的热量为32.8 kJ,故参加反应的CO的物质的量$\frac{32.8kJ}{41kJ}$×1mol=0.8mol,CO的转化率为$\frac{0.8mol}{1mol}$×100%=80%,故A正确;
B.容器①②温度相同,平衡常数相同,根据容器①计算平衡常数,由A计算可知,平衡时CO的物质的量变化量为0.8mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol):1 4 0 0
变化(mol):0.8 0.8 0.8 0.8
平衡(mol):0.2 3.2 0.8 0.8
故平衡常数k=$\frac{0.8×0.8}{0.2×3.2}$=1,
故容器②中的平衡常数为1,令容器②中CO2的物质的量变化量为amol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):1 4 0 0
变化(mol):a a a a
平衡(mol):1-a 4-a a a
所以$\frac{a×a}{(1-a)(4-a)}$,解得a=0.8
CO2的转化率为$\frac{0.8mol}{1mol}$×100%=80%,故B正确;
C.速率之比等于化学计量数之比,故容器①中CO反应速率等于H2O的反应速率,故C正确;
D.由A中计算可知容器①平衡时CO2的物质的量为0.8mol,由B中计算可知容器②中CO2的物质的量为1mol-0.8mol=0.2mol,容器的体积相同,平衡时,两容器中CO2的浓度不相等,故D错误;
故选D.
点评 本题考查化学平衡的有关计算,难度中等,注意B选项中可以利用代换法理解解答,避免计算的繁琐.


科目:高中化学 来源: 题型:解答题

| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 Al(OH)3 | 2.7 3.7 | 3.7 4.7 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | |
| B. | 物质的量 C:CuO:Fe=3:2:2 | |
| C. | 质量 MnO2:CuO:C=5.5:8:1.2 | |
| D. | 质量 Fe:C:CuO=7:5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳氧化物的转化有重大用途,回答关于CO和CO2的问题.
碳氧化物的转化有重大用途,回答关于CO和CO2的问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | CuSO4与Ba (OH)2溶液混合 Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓ | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-=CaCO3↓ | |
| D. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | NH4Cl的电子式: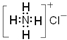 | |
| C. | 原子核内有10个中子的氧原子${\;}_{8}^{18}O$ | |
| D. | 次氯酸分子结构式 H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
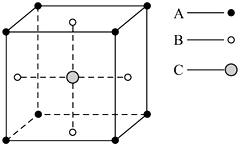
| A. | 1:3:1 | B. | 2:3:1 | C. | 2:2:1 | D. | 1:3:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com