
催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
⑴人们常用催化剂来选择反应进行的方向。如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。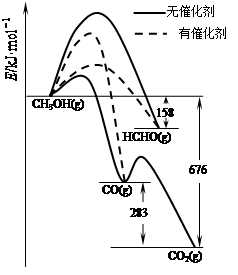
①在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2或HCHO”)。
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
③在稀硫酸催化下,HCHO可以通过反应生成分子式为C3H6O3的环状三聚甲醛分子,其分子中同种原子的化学环境均相同。写出三聚甲醛的结构简式: 。
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
⑵一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O="2n" CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
⑴①HCHO ②-470kJ·mol-1 ③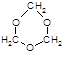
④AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O或AgCl+2NH3=Ag(NH3)2++Cl-
⑵①防止酸雨的发生 8
②SO2+2H2O+Cu2+ 4H++SO42―+Cu
4H++SO42―+Cu
解析试题分析:⑴①反应活化能越低,越容易进行,有催化剂生成HCHO的活化能低,故发生该反应;
②△H=-(676-283)×2=-470kJ·mol-1;③该反应为碳氧双键的加成反应;④该反应是形成Ag(NH3)2+配离子,AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O或AgCl+2NH3=Ag(NH3)2++Cl-;(2)①二氧化硫对环境的污染是酸雨;被SO2还原的O2的质量也就是从其得到电子的氧气的质量,m(O2)=11.2÷22.4×2÷4×32=8g
②根据信息确定产物为铜和SO42-,方程式为SO2+2H2O+Cu2+ 4H++SO42―+Cu。
4H++SO42―+Cu。
考点:考查化学原理综合有关问题。


科目:高中化学 来源: 题型:填空题
(12分)某工业废水肿含有一定量的Cr2O72-和CrO42-,现
取样该工业废水,检测其中铬的含量。
步骤I:取25. 00 mL废水,加入适后稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,滴人几滴指示剂。
步骤Ⅲ: 用o .1000 mol·L-1Na2S2O3溶液滴定(I2+2Na2 S2O3= 2NaI+Na2S4O6)
达到终点时消耗溶液24. 00 mL。
步骤Ⅳ:将上述反应后的溶液进行如下处理:反应后废液
回答下列问题
(1)步骤I加入稀硫酸酸化的目的是 ;
(2)步骤Ⅱ中发生如下反应,请完善并配平离子方程式
该步骤中所加指示剂是 ;
(3)步骤Ⅲ判断滴定达到终点的现象是__ __。
(4)步骤Ⅳ在生产生活中的意义是____ (任答一条);
(5)计算工业废水中铬元素的含量是 mg/L.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁及其化合物在生产、生活中存在广泛用途,完成下列填空。
(1)如图所示为铁元素在周期表中的信息,方格中“55.85”的意义为: 。铁原子核外有 种运动状态不同的电子。
(2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于 晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为图中的 (选填“a”或“b”)。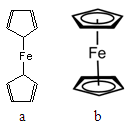
(3)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,
写出发生变质反应的离子方程式 。
(4)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是 。
(5)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4 + 6Na2O2 → 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为 mol。
(6)高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含 Mn2+ 1mg的水体样本,需要1.2 mg/L高铁酸钾 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知33As、35Br位于同一周期。某反应中反应物与生成物有以下几种:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式是 。
(3)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将该反应方程式配平后,氧化剂和还原剂的物质的量之比为 ,其中1 mol KBrO3得到电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应综合应用:氧化还原反应滴定
(1)配平氧化还原反应方程式:
C2O42-+ MnO4-+ H+= CO2↑+ Mn2++ H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为 mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作 (填“氧化剂”或“还原剂”),该滴定过程 (填“需要”或“不需要”)另加指示剂。滴至16 mL时反应完全,此时溶液颜色由 变为 。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果 (填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果 (填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为 ,KHC2O4的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学知识在各个领域应用广泛。如:
(1)2003年10月15日,我国成为世界上第三个将人送入太空的国家,这次载人航天发射使用
的“长征”二号火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮为氧化剂,燃烧主要产生CO2、N2等气体,放出的巨大能量把火箭送入太空。反应的化学方程式为: 。(2分)
(2)管道工人曾经用浓氨水检验氯气管道。如果氯气管道某处漏气,会出现白烟现象。氨与氯
气反应的化学方程式为: 。(2分)出现白烟现象的化学方程式为: 。(2分)
(3)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。工业生产ClO2过程是将食盐
水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。反应的化学方程式为: 。(2分)
(4)赏心悦目的雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的。这一过程中发生反应的化学方
程式为: 。(2分)
(5)维生素C在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+。这说明维生素C具有 。(填“氧化性”或“还原性”)(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用离子方程式解释NaHC2O4溶液显酸性的原因:________________。
(2)常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,比较所得溶液中各种离子浓度的大小关系:________________。
(3)配平以下氧化还原反应方程式。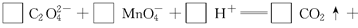
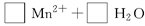
(4)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份该溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加20 mL 0.25 mol/L NaOH溶液时,溶液由无色变为浅红色。该溶液中被中和的H+的物质的量为________mol。
②第二份溶液中滴加16mL 0.10mol/L酸性KMnO4溶液时反应完全,该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4·2H2O的物质的量为________mol,KHC2O4的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某学生往一支试管里按一定次序分别加入下列几种物质:
| A.KI溶液, | B.淀粉溶液, | C.NaOH溶液, | D.氯水。发现溶液颜色按下面次序变化: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)_______________________________________________________________。
(2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________________________________。
(3)第④步通入CO2,可以使MnO42-发生反应,生成MnO4-和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为____________________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、___________、洗涤、干燥。干燥过程中,温度不宜过高,因为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com