
| A�� | ����Һ���������Եõ�4 mol NaCl | |
| B�� | ����Һ���ɲ����գ��õ��Ĺ��������NaCl��NaBr��Na2SO4 | |
| C�� | ����Һ�еμ�KI������Һ����Һ������������һ������ | |
| D�� | ��ͨ�����������Ϊ11.2 L����״��������Ӧ�����ӷ���ʽΪ��2I-+Cl2=I2+2C1- |
���� �����Һ�л�ԭ��I-��Br-�����ʵ�����Ϊl mol��ͨ�������������ķ�ӦΪ��2I-+Cl2=I2+2Cl-��2Br-+Cl2=2Cl-+Br2��������������������Һ�к���NaCl��Na2SO4����������������Һ�п���ΪNaI��NaBr��Na2SO4��NaBr��Na2SO4��
A����Һ�������õ��Ȼ��Ƶ��������ݵ⻯�ƺ��廯��ȫ�����������������
B����һ���������������⻯�ƺ������廯�ƻ������廯�ƣ��õ���Һ���յõ����������NaCl��NaBr��Na2SO4 ��
C������Һ�еμ�KI������Һ����Һ���������������⻯�����ɵⵥ�ʣ����ܲ������廯�ƻ������廯�ƣ�
D���������ʵ���=$\frac{11.2L}{22.4L/mol}$=0.5mol�����ݷ�Ӧ�����ӷ���ʽ������ϵ���㣬
2I-+Cl2=I2+2Cl-��
2 1
1mol 0.5mol
����ǡ�ú͵⻯�Ʒ�Ӧ��
��� �⣺�����Һ�л�ԭ��SO32-��I-��Br-�����ʵ�����Ϊl mol��ͨ������˳��Ӧ�������ķ�ӦΪ��Cl2+SO32-+H2O=SO42-+2H++2Cl-��2I-+Cl2=I2+2Cl-��2Br-+Cl2=2Cl-+Br2��������������������Һ�к���NaCl��Na2SO4����������������Һ�п���ΪNaI��NaBr��Na2SO4��NaBr��Na2SO4��
A����Һ�������õ��Ȼ��Ƶ��������ݵ⻯�ƺ��廯��ȫ�����������������
2I-+Cl2=I2+2Cl-��
2 1 2
1mol 0.5mol 1mol
2Br-+Cl2 =2Cl-+Br2��
2 1 2
1mol 0.5mol 1mol
���Ϊ2 mol NaCl����A����
B����һ���������������⻯�ƺ������廯�ƻ������廯�ƣ��õ���Һ���յõ����������NaCl��NaBr��Na2SO4 ����B��ȷ��
C������Һ�еμ�KI������Һ����Һ���������������⻯�����ɵⵥ�ʣ����ܲ������廯�ƻ������廯�ƣ���������������C����
D���������ʵ���=$\frac{11.2L}{22.4L/mol}$=0.5mol�����ݷ�Ӧ�����ӷ���ʽ������ϵ���㣬
SO32-+Cl2=2Cl-+SO42-
1 1
0.5mol 0.5mol
����ǡ�ú��������Ʒ�Ӧ����Ӧ�����ӷ���ΪSO32-+Cl2=2Cl-+SO42-������D����
��ѡB��
���� ���⿼����������ԭ��Ӧ˳����еķ���Ӧ�ã���Ҫ���������ʺͶ�������ķ����жϣ����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2��Na2SO4 | B�� | CO2��H2O | C�� | NaOH��NaCl | D�� | KCl��HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
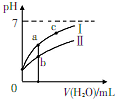 ��֪�±�Ϊ250CʱijЩ����ĵ���ƽ�ⳣ������ͼ��ʾ����ʱ��ϡ��CH3COOH��HC1O�������ϡ��Һʱ����ҺpH���ˮ���ı仯������������Ϣ������˵����ȷ���ǣ�������
��֪�±�Ϊ250CʱijЩ����ĵ���ƽ�ⳣ������ͼ��ʾ����ʱ��ϡ��CH3COOH��HC1O�������ϡ��Һʱ����ҺpH���ˮ���ı仯������������Ϣ������˵����ȷ���ǣ�������| CH3COOH | HClO | H2CO3 |
| Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.4��10-7 Ka2=4.7��10-11 |
| A�� | ��NaCl0��Һ��ͨ������������̼�����ӷ���ʽΪ��2C1O-+CO2+H2O=2HClO+CO32- | |
| B�� | ��ͬŨ�ȵ�CH3COONa��NaClO�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c��Na+����c��ClO-����c��CH3COO-����c��OH-����c��H+�� | |
| C�� | a��b��c������ʾ��Һ��ˮ�ĵ���̶ȣ�c��a��b | |
| D�� | ͼ���У�I��ʾCH3COOH�����ʾHC1O������Һ�����ԣ�c��b��a |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����и�����Ʒ������Ҫ������������ʴ���� | |
| B�� | ������ʹ�õĺ��������й©�����ӿ�����PM 2.5�ĺ��� | |
| C�� | �����ͻ���̿������ΪƯ����ͬʱʹ�ÿ���ǿƯ��Ч�� | |
| D�� | ����[KAl��SO4��2•12H2O]����ˮ���γɽ��壬��˿���������ˮ��ɱ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  �μ�Һ�� | B�� | 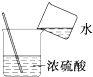 ϡ��Ũ���� | C�� |  ��������� | D�� | 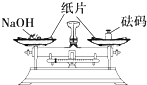 ����NaOH���� ����NaOH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��þ�� | ��ɰ | ���� | ƫ������ |
| Mg2B2O5•H2O | Na2B4O7•10H2O | H3BO3 | NaBO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������������з�Ӧ��1mol��ʧȥ�ĵ�����Ϊ2NA | |
| B�� | ��״����22.4LH2�к�������Ϊ2NA | |
| C�� | NaBH4��һ����Ҫ�Ĵ������壬1molNaBH4��ˮ��Ӧ[NaBH4+2H2O=NaBO2+4H2��]ʱת�Ƶĵ�����ĿΪ8NA | |
| D�� | �����£�1L0.2mol/L��������Һͨ�˰�������ҺpH=7������Һ��NH4+��Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��n��HA��=n��NaOH������a+b��14 | B�� | ��n��HA����n��NaOH������a+b��14 | ||
| C�� | ����Ϻ���ҺpH=7����n��HA����n��NaOH�� | D�� | ����Ϻ���ҺpH��7����n��HA����n��NaOH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��NaOH��Һ��ͨ�����CO2��2OH-+CO2=CO32-+H2O | |
| B�� | ����Ȼ�þ��Һ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2��+2OH- | |
| C�� | ��H2O2��Һ�м���MnO2��2H2O2+4H++MnO2=O2��+Mn2++4H2O | |
| D�� | ��KAl��SO4��2��Һ�еμ�Ba��OH��2��Һ��SO42-������ȫ��Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4��+2H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com