
| A. | m=2 | |
| B. | X与Y的转化率相等 | |
| C. | 该温度下的平衡常数约为9.3×10-3 | |
| D. | 重新建立平衡时Z的浓度为0.4mol•L-1 |
分析 向平衡体系中再加入1molZ,重新建立平衡时X、Y、Z的体积分数不变,说明压强不影响该平衡,则反应前后总计量数相等,则1+m=3,m=2;X、Y的初始浓度之比为1:2,计量数之比为1:2,则二者的转化率相等;根据重新达到平衡时Z的体积分数不变及反应过程中总物质的量不变计算出Z的物质的量,再根据c=$\frac{n}{V}$计算出Z的浓度;
根据反应前后总物质的量不变及各组分的体积分数计算出第一次平衡时各组分的物质的量,然后根据c=$\frac{n}{V}$计算出平衡浓度,最后根据平衡常数的表达式计算出该反应在该温度下的平衡常数.
解答 解:A.向平衡体系中再加入1molZ,重新建立平衡时X、Y、Z的体积分数不变,说明压强不影响该平衡,则反应前后总计量数相等,则1+m=3,m=2,故A正确;
B.向2L的密闭容器中加入1molX和2molY,由于m=2,则反应过程中消耗X、Y的物质的量之比为1:2,所以X、Y的转化率一定相等,故B正确;
C.由于反应前后气体的总物质的量不变,平衡时气体的总物质的量仍然为1mol+2mol=3mol,则第一次平衡时X、Y、Z的物质的量浓度分别为:c(X)=$\frac{3mol×30%}{2L}$=0.45mol/L,c(Y)=$\frac{3mol×60%}{2L}$=0.9mol/L,c(Z)=$\frac{3mol×10%}{2L}$=0.15mol,则该反应在该温度下的平衡常数为:K=$\frac{0.1{5}^{3}}{0.45×0.{9}^{2}}$≈9.3×10-3,故C正确;
D.再加入1molZ后总物质的量为4mol,重新达到平衡时Z的体积分数仍然为10%,则重新建立平衡时Z的浓度为:$\frac{4mol×10%}{2L}$=0.2mol/L,故D错误;
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握化学平衡常数的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

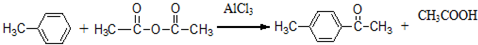
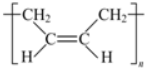 .
. .
. .
.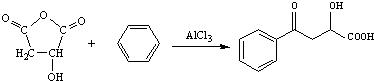 .
.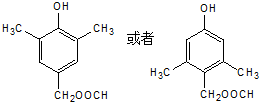 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
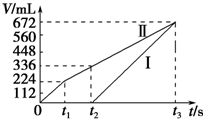 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由苯与氢气生成环己烷;由乙烯制一氯乙烷 | |
| B. | 乙醇与乙酸制取乙酸乙酯;油脂的皂化反应 | |
| C. | 乙烯与氧气制环氧乙烷;乙醇制乙醛 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色;丙烯酸使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
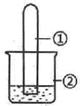 用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | HCHO | 新制Cu(OH)2悬浊液 | 产生白色沉淀 |
| D | CH3Cl | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓海水中存在反应 Br2+H2O?HBr+HBrO | |
| B. | 纯碱溶液显碱性的原因是 CO32-+2H2O?H2CO3+OH- | |
| C. | 海水中提取溴还可用到的反应 Cl2+2Br-═2Cl-+Br2 | |
| D. | 纯碱吸收溴的主要反应是3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com