
图3-4
(1)对试管以热水浴的方式加热,观察试管中的溶液,结果是_____________(有现象就写明现象的内容,无现象就写明无现象的原因)。
(2)把加热后的试管放入约20 ℃的水中冷却,观察现象,试管中的溶液里有明显的现象,它是______________(有现象就写明现象的内容,无现象就写明无现象的原因)。
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:阅读理解

| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点/℃ | 20.8 | 117.9 | 290 | 197.2 | 100 |
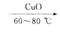
图6-24
请回答下列问题:
(1)试管A内在60—80 ℃时发生的主要反应的化学方程式为(注明反应条件)________________________________________________________。
(2)如图所示,在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在____________;当试管A内主要反应完成后温度计水银球的位置应在___________,目的是___________________________________________________。
(3)烧杯B的作用是__________;烧杯B内盛装的液体可以是(写出一种即可)__________。
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸,红色的石蕊试纸,白色的醋酸铅试纸,碳酸氢钠粉末。实验仪器任选。该方案为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(一)(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图3—2所示的游码尺上画出游码的位置(画“|”表示)。
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |

(2)图3—3表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是__________mL。
(3)配制![]() 的硫酸溶液200mL所需的玻璃仪器为___________。
的硫酸溶液200mL所需的玻璃仪器为___________。
(二)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定的方法,具体步骤为:
(1)将固体NaCl细粒干燥后,准确称取mg NaCl固体并转移到定容仪器A中;
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积![]() 。
。
请回答下列问题:
①步骤(1)中A仪器最好使用___________。(填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
②步骤(2)中用酸式滴定管还是用碱式滴定管______________,理由是_____________。
③能否用水代替苯__________,理由是____________。
④已知NaCl晶体中,靠得最近的![]() 与
与![]() 间的平均距离为a cm(如图3—4),用上述测定方法测得的阿伏加德罗常数
间的平均距离为a cm(如图3—4),用上述测定方法测得的阿伏加德罗常数![]() 的表达式为_______________。
的表达式为_______________。

(三)在配制物质的量浓度溶液时,下列操作出现的后果是(填:“溶液浓度不准确”、“偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。
(2)配制氢氧化钠溶液时,溶液不能澄清,溶质少量不溶解。____________。
(3)配制氯化钠溶液时,容量瓶中有少量水。______________。
(4)定容时,液面上方与刻度相齐时,停止加水。__________。
(5)配制好溶液后,容量瓶未塞好,洒出一些溶液。_____________。
(6)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
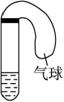
实验:将硫酸亚铁晶体(FeSO4?7H2O)加入如图1中所示的干燥试管A里,隔绝空气加强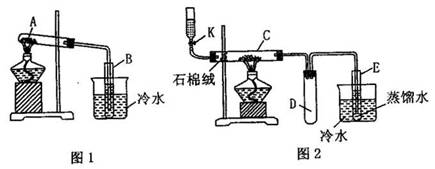
充分反应后,试管A中得残留固体甲,在试管B内得到无色液体乙。取出甲放在图2中的石英管C中,连接好其他部分的仪器后,开启旋塞K,逐滴滴加乙醇使C左部石棉绒(一种纤维状硅酸盐材料,很稳定,不燃烧)浸润吸足,关闭K,然后加热,几分钟左右(加热过程中还可以较快地开启、关闭旋塞K来补充乙醇并使之通入石棉绒里),可观察到甲的颜色由红棕色逐渐变为黑色。反应停止后,取试管E中的液体0.5ml,逐滴加入到含新配制的银氨溶液的试管F中,振荡后,把试管放在水浴中温热,不久会观看到试管内壁上附着一层光亮如镜的金属银。
回答下列问题:
(1)写出如图1所示的干燥试管A中发生反应的化学方程式:_____________________________。
(2)根据反应原理请你评价图1实验装置的主要缺点_____________________________________。
(3)试管C中反应的化学方程式为:________________________________________。
(4)简述如何检验图2所示装置气密性:__________________________________。
(5)试管D安装在此的作用是:_______________________________________。
(6)写出E试管中反应的化学方程式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com