
����Ŀ�������п���˫��ˮ������������ƺ����ˮ��ij��ѧ��ȤС��ģ��÷�̽���й����ض����跴Ӧ���ʵ�Ӱ�죨ע�����跴Ӧ��ָ��������CN�������ķ�Ӧ����
��������ϡ�
���軯����Ҫ����CN����[Fe��CN��6]3��������ʽ���ڣ�
��Cu2+����Ϊ˫��ˮ���������账�������еĴ�����Cu2+��ƫ���������¶�˫��ˮ�ֽ�Ӱ����������Ժ��Բ��ƣ�
��[Fe��CN��6]3����CN���ѱ�˫��ˮ��������pHԽ��[Fe��CN��6]3��Խ�ȶ���Խ�ѱ�������
��ʵ����̡�
�ڳ����£����ƺ����ˮ��Ʒ������ij�ʼŨ�Ⱥʹ���Cu2+��Ũ����ͬ�����ں����ˮ��Ʒ��ͬ�ij�ʼpH��һ��Ũ��˫��ˮ��Һ��������������¶Ա�ʵ�飺
��1�����������ʵ����Ʊ������в�Ҫ���ո�
ʵ�� | ʵ��Ŀ�� | ��ʼpH | ��ˮ��Ʒ���/mL | CuSO4��Һ�����/mL | ˫��ˮ��Һ�����/mL | ����ˮ�����/mL |
�� | Ϊ����ʵ������ο� | 7 | 60 | 10 | 10 | 20 |
�� | ��ˮ�ij�ʼpH�����跴Ӧ���ʵ�Ӱ�� | 12 | 60 | 10 | 10 | 20 |
�� | 7 | 60 | 10 |
��2��ʵ���ú����ˮ�е�����Ũ�ȣ���CN����ʾ����ʱ��仯��ϵ��ͼ��ʾ��
ʵ�����20��60minʱ��η�Ӧ���ʣ��ԣ�CN����= molL��1min��1 ��
��3��ʵ��ٺ�ʵ��ڽ�������������ˮ�ij�ʼpH�������跴Ӧ���ʼ�С����ԭ������� ����һ�㼴�ɣ�����ƫ���������£������ˮ�е�CN�����ձ�˫��ˮ����ΪHCO3�� �� ͬʱ�ų�NH3 �� ��д���÷�Ӧ�����ӷ���ʽ�� ��
��4������ȤС��ͬѧҪ̽��Cu2+�Ƿ��˫��ˮ���������跴Ӧ������ã�������������ʵ�鲢��֤�������ۣ�����±������ݣ�����֪����ˮ�е�CN��Ũ�ȿ�������ɫ���Dzⶨ��
ʵ�鲽�裨��Ҫд������������̣� | Ԥ��ʵ������ͽ��� |
���𰸡�
��1��˫��ˮ��Ũ�ȶ����跴Ӧ���ʵ�Ӱ�죻10��20
��2��0.0175
��3����ʼpH������Cu2+���γ�Cu��OH��2������Ӱ����Cu2+�Ĵ����ã����ʼpH����[Fe��CN��6]3�������Ժ����������¸��ȶ���������������CN��+H2O2+H2O�TNH3��+HCO3��
��4���ֱ�ȡ���������Ũ�ȵĺ����ˮ�ڼס�����֧�Թ��У��ٷֱ������������Ũ�ȵ�˫��ˮ��Һ��ֻ����Թ��м�����������ˮ����ͭ��ĩ��������ɫ���Dzⶨ��ͬ��Ӧʱ������֧�Թ��е�CN��Ũ�ȣ���ͬʱ���ڣ������Թ��е�CN��Ũ��С�����Թ��е�CN��Ũ�ȣ���Cu2+��˫��ˮ���跴Ӧ������ã������Թ��е�CN��Ũ����ͬ����Cu2+��˫��ˮ���跴Ӧ���������
���������⣺��1.��Ӱ��÷�Ӧ��������pH�Լ�˫��ˮ��Ũ�ȣ�ʵ��Ŀ��Ϊ��ˮ�ij�ʼpH�����跴Ӧ���ʵ�Ӱ���˫��ˮ��Ũ�ȶ����跴Ӧ���ʵ�Ӱ�죬������Ӧ���䣬������������䣬����ˮ�����Ϊ10mL������˫��ˮ�����Ϊ20mL�����Դ��ǣ�˫��ˮ��Ũ�ȶ����跴Ӧ���ʵ�Ӱ�죻10��20��
��2.������v= ![]() =
= ![]() =0.0175molL��1min��1 �� ���Դ��ǣ�0.0175��
=0.0175molL��1min��1 �� ���Դ��ǣ�0.0175��
��3.��pHԽ��[Fe��CN��6]3��Խ�ȶ���Խ�ѱ��������������跴Ӧ���ʼ�С����Ϊ���ˮ�е�CNһ���ձ�˫��ˮ����ΪHC03 �� ���е�̼��+2�۱��+4�ۣ�1molת��2mol�ĵ��ӣ�����������1molҲת��2mol�ĵ��ӣ�����CNһ��H2O2�����ʵ���֮��Ϊ1��1�����Է�Ӧ�����ӷ���ʽΪ��CN��+H2O2+H2O�TNH3��+HCO3�� �� ���Դ��ǣ���ʼpH������Cu2+���γ�Cu��OH��2������Ӱ����Cu2+�Ĵ����ã����ʼpH����[Fe��CN��6]3�������Ժ����������¸��ȶ���������������CN��+H2O2+H2O�TNH3��+HCO3����
��4.���ֱ�ȡ�¶���ͬ�������Ũ����ͬ�ĺ����ˮ���������ȷݣ��μӹ������⣬һ���м�����������ˮ����ͭ��ĩ����һ�ݲ��ӣ���������ɫ���Dzⶨ��ˮ�е�CNһŨ�ȣ��������ͬʱ���ڣ������Թ��е�CN��Ũ��С�����Թ��е�CN��Ũ�ȣ���Cu2+��˫��ˮ���跴Ӧ������ã���֮��������ã�
���Դ��ǣ�
ʵ�鷽������Ҫ��д������������̣� | Ԥ��ʵ������ͽ��� |
�ֱ�ȡ���������Ũ�ȵĺ����ˮ�ڼס�����֧�Թ��У��ٷֱ������������Ũ�ȵ�˫��ˮ��Һ��ֻ����Թ��м�����������ˮ����ͭ��ĩ��������ɫ���Dzⶨ��ͬ��Ӧʱ������֧�Թ��е�CN��Ũ�� | ��ͬʱ���ڣ������Թ��е�CN��Ũ��С�����Թ��е�CN��Ũ�ȣ���Cu2+��˫��ˮ���跴Ӧ������ã������Թ��е�CN��Ũ����ͬ����Cu2+��˫��ˮ���跴Ӧ��������� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����ϵ���ѧ�о��������(����)
A. ����������
B. �ϳ��²���
C. �о���ѧ��Ӧ���۹���
D. �о���ѧ��Ӧ��ԭ���غ��ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡһ�����������и������ʻ�Ϻ������Ժ��ֱ�����ϣ�����ȼ�պ�һ���ܵõ���ͬ���ʵ����Ķ�����̼��ˮ���ǣ� ��
A.C2H2 C2H6
B.CH4 C3H8
C.C3H6 C3H8
D.C2H4 C4H8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������ᷢչ��������Ҫ�����ã�չ��δ������ѧ��ѧ����ʮ�ֹ�����̽���ռ䡣�����йػ�ѧ��ѧ�������У�����ȷ����(����)
A.���Ͻ��⼼���뻯ѧ��ѧ��
B.��ѧ��ѧ����������η��������Ϊ
C.����Դ�������뻯ѧ�������
D.���Ż�ѧ��ѧ�ķ�չ���ϳɲ��Ͻ�Խ��Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڳ���Ԫ���γɵ�����A��B��C��D��E��F��ת����ϵ��ͼ1��ʾ������A������B֮��ķ�Ӧ������Һ�н��У�E������A��B���������е�ij����ͬ��Ҳ���ܲ�ͬ������ش��������⣺ 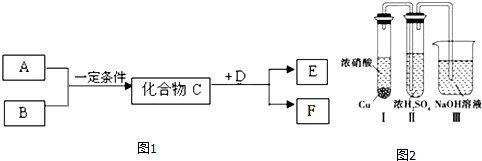
��1����C��һ�ֵ���ɫ���ӻ����B��EΪͬ�����壬F��һ��ˮ��Һ�Լ��Ե����Σ�д��C��D��Ӧ�Ļ�ѧ����ʽ
��2����A��B��Ӧ����C���˹���ҵ�̵��ķ�Ӧԭ����D��˫ԭ�ӷ�����̬���ʣ����ܶ�Ϊ3.17g/L��������£���F�ڳ�������һ����ɫ���壬�������ֽ⣬д��ʵ���Ҽ�������F�������ӵķ����� ��
��3����C��һ�����壬D�ڳ�������һ����ɫ��ζ��Һ�壬EΪ��ɫ���壬F��һ��ǿ�ᣮ
��C��D��Ӧ�Ļ�ѧ����ʽ ��
��������Ϊ��ŨH2SO4���Ը�������C������ͬѧΪ����֤�ù۵��Ƿ���ȷ����ͼ2װ�ý���ʵ�飮ʵ������У���Сͭ���Ũ����տ�ʼ��Ӧ��һ��ʱ����ŨH2SO4��δ�����������ݳ�����Ũ������ɫ�������ó��Ľ����� ��
�ۼ�ͬѧ��Ƶ�ʵ���У�װ�â����Ҫ���� ��
�ܼ�ͬѧ��ʵ�������װ�â��ڷ���һ������ԭ��Ӧ�����������Σ�����һ���������ʳ�κ����Ƶ��ж������������Σ�д���÷�Ӧ�ķ���ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�������Ϊ4�ֶ�����Ԫ�أ������ڱ��У������ҡ������������ڱ��е�λ�ù�ϵ����ͼ��ʾ��ԭ���������ң�����������ԭ���������ҡ���ԭ������֮����ȣ�4��Ԫ��ԭ�ӵ�����������֮��Ϊ24�������ж���ȷ���ǣ� ��
A.Ԫ�ؼļ���̬�⻯���ȶ��Ա��ҵ�ǿ
B.Ԫ���������ڱ��е�λ��Ϊ��2���ڣ�VIA��
C.Ԫ�ر���Ԫ�ض�������������Ӧ��ˮ�����Ϊǿ��
D.4��Ԫ�صļ������Ӱ뾶�Ӵ�С˳��Ϊ�������ң�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1��ʾ����ijͬѧͨ��ʵ��ó���H2O2��Һ��Ũ����ø�ٷ�Ӧ���ʹ�ϵͼ��ͼ2��ʵ������е�һ��װ��ͼ��������ش��������⣺
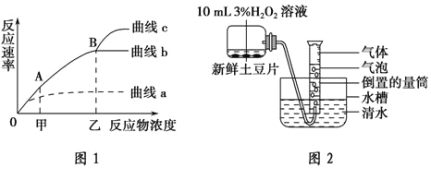
��1��ͼ1��AB��˵����Ӧ���ʴ�С��Ҫ�� �йأ���Ӧͼ2�е�ʵ��װ���������� ��
��2�����ͼ2װ���з�����Ǿ����´�����������Ƭ��ʵ�������� ��ԭ���� ��
��3��ʵ��������¶ȡ�pH�ȱ��ֲ��䣬�γ�����a������b����Ŀ���ԭ���� ����ͼ2װ���к�����������Ƭ����ƿ�ֱ�����ڲ�ͬ�¶ȵ�ˮԡ���У���ʱ��¼��ͬ�¶������²����������������Ƴ����¶ȶ�H2O2øø�ٷ�Ӧ����Ӱ�������ͼ������ѧ����ԭ���� ��
��4������b��B���Ӧ���ʲ������ӵ�ԭ���� ������c�γɵĿ���ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ������ʹ�ù㷺�Ľ�����ʹ�����ϳ�ԭ��Ϊ��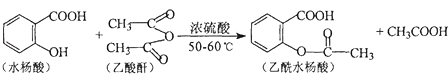
��1��ˮ����ķ���ʽΪ ��
��2��ˮ���Ậ�������ŵ�������
��3���й�ˮ�����˵��������ȷ������
A.������ˮ����ȡ���ͼӳɷ�Ӧ
B.��ʹ����KMnO4��Һ��ɫ
C.1molˮ�������������2mol NaOH
D.�� FeCl3��Һ����ɫ
��4��д��һ�ַ�������������ˮ�����ͬ���칹��Ľṹ��ʽ ��
���ܷ���������Ӧ
����FeCl3��Һ����ɫ
�۱����ϵ�һ��ȡ����ֻ��2��
��5�������ȣ�CH3COCl ����ˮ���ᷴӦ������������ˮ���ᣬ��ѧ��Ӧ����ʽ������д��������
��6������ˮ����������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᡢ���ᡢ��������ᶼ��ǿ�ᣬ��������ˮ��Һ�в��������ij�¶������������ڱ������еĵ��볣�����ӱ������ж�����˵������ȷ���ǣ� ��
�� | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6��10��5 | 6.3��10��9 | 1.6��10��9 | 4.2��10��10 |
A.�ڱ������У��������������ǿ
B.ˮ�������������ǿ��û����������������������������������ǿ��
C.�ڱ�������1mol/L�ĸ�����ĵ����ԼΪ0.4%
D.�ڱ�����������ĵ��뷽��ʽΪ��H2SO4�T2H++SO42��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com