
| A. | 相同温度时,100mL0.01mol/L的醋酸溶液与10mL0.1mol/L的醋酸溶液相比较,H+的物质的量前者等于后者 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,若将含1mol CH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3KJ | |
| C. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| D. | N2(g)+3H2(g)═2NH3(g)△H<0.其他条件不变时升高温度,反应速率和氢气的平衡转化率均增大 |
分析 A.两溶液中醋酸的物质的量相等,醋酸浓度越大,醋酸的电离程度越小;
B.醋酸为弱电解质,电离过程会吸热,导致反应中放热热量减少;
C.该溶液为燃烧反应,燃烧反应为放热反应;
D.该反应为放热反应,升高温度后平衡向着逆向移动,氢气的转化率减小.
解答 解:A.100mL0.01mol/L的醋酸溶液与10mL0.1mol/L的醋酸溶液中含有醋酸的物质的量都是0.001mol,醋酸浓度越大,醋酸的电离程度越小,则前者溶液中前者浓度大于后者,故A错误;
B.在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,由于醋酸电离吸收热量,则将含1mol CH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3kJ,故B正确;
C.反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,△H-T△S<0,该反应的△S<0,则△H<0,反应可能自发进行,故C错误;
D.升高温度后反应速率增大,而该反应为放热反应,升高温度后平衡向着逆向移动,氢气的转化率减小,故D错误;
故选B.
点评 本题考查较为综合,涉及弱电解质的电离平衡及其影响、反应热与焓变、化学平衡及其影响等知识,C为易错点,注意掌握判断反应能否自发进行的方法.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
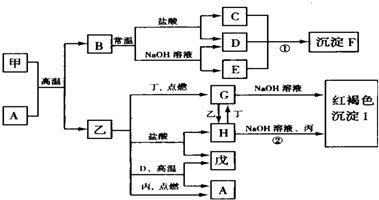 已知在一定条件下可实现如图所示物质之间的变化,其中甲、乙为金属单质,丙、丁、戊为非金属单质,B为氧化物.
已知在一定条件下可实现如图所示物质之间的变化,其中甲、乙为金属单质,丙、丁、戊为非金属单质,B为氧化物. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 C:CH3COOH
C:CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 质量分数为98%硫酸,用10mL 水稀释后,硫酸的质量分数小于49% | |
| B. | 向两等份不饱和的烧碱溶液中分别加入一定量的氧化钠和过氧化钠,使溶液均恰好饱和,则加入的氧化钠和过氧化钠的物质的量之比等于1:1(温度不变) | |
| C. | 36.5 克HCl 溶解在1L 水中,所得溶液的密度为ρ g/ml,质量分数为ω,物质的量溶液为c mol/L,则ω=36.5c/ρ | |
| D. | 上述36.5g HCl 气体占有的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| B. | 用氢氧化钠溶液除去镁粉中的铝粉:2Al+2OH-═2AlO2-+H2↑ | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-═NH3↑+H2O | |
| D. | 将食醋与“84”消毒液混合产生黄绿色气体:2H++Cl-+ClO-═Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度 | |
| B. | 0.02 mol•L-1HCl溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合后,溶液pH约为12 | |
| C. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | |
| D. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 时间(s) | 0 | 500 | 1000 | 1500 |
| c(N2O5)(mol•L) | 0.50 | 0.35 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取10.1mL盐酸 | |
| B. | 用100mL量筒量取15.2mL盐酸 | |
| C. | 用托盘天平秤取25.20gNaCl | |
| D. | 用100mL容量瓶配制90mL0.10mol/LNaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com