
| A. | 1 L 0.2 mol•L-1 CH3COONa溶液中含有0.2NA个CH3COO- | |
| B. | 标准状况下,22.4 L CO2含有NA个碳氧双键 | |
| C. | 一定温度下,将2 mol SO2和1 mol O2充入装有催化剂的容器中发生反应,转移4NA个电子 | |
| D. | 1 mol羟基(-OH)中含9NA个电子 |
分析 A.醋酸根离子部分水解,导致醋酸根离子的数目减少;
B.二氧化碳分子中含有两个碳氧双键,1mol二氧化碳分子中含有2mol碳氧双键;
C.二氧化硫与氧气的反应为可逆反应,反应物不可能完全转化;
D.羟基中含有9个电子,1mol羟基含有9mol电子.
解答 解:A.1 L 0.2 mol•L-1 CH3COONa溶液中含有0.2mol醋酸钠,由于醋酸根离子部分水解,则溶液中含有CH3COO-的数目小于0.2NA,故A错误;
B.标准状况下,22.4 L CO2的物质的量为1mol,1mol二氧化碳分子中含有2mol碳氧双键,则含有2NA个碳氧双键,故B错误;
C.2 mol SO2和1 mol O2完全转化成2mol三氧化硫时转移4mol电子,由于该反应为可逆反应,则反应结束后转移电子的物质的量小于4mol,转移电子的数目小于4NA,故C错误;
D.1 mol羟基(-OH)中含有9mol电子,含9NA个电子,故D正确;
故选D.
点评 本题考查较为综合,涉及盐的水解、可逆反应、物质组成与结构等知识,题目难度不大,明确可逆反应特点为解答关键,D为易错点,注意羟基与氢氧根离子的区别,试题培养了学生的灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾具有消毒杀菌作用,可用于净水 | |
| B. | BaSO4在医学上用做钡餐,Ba2+对人体无毒 | |
| C. | 碳酸氢钠和氢氧化铝均可用于治疗胃酸过多 | |
| D. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\stackrel{催化剂}{→}$C+NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
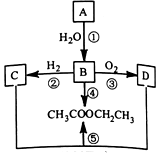 烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答:
烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和乙醇酯化时,采用沸水浴加热 | |
| B. | 可用先加NaOH再分液方法,除去乙醇中的乙酸乙酯 | |
| C. | 可通过灼烧再闻气味的方法,区分蚕丝和羊毛 | |
| D. | 可通过分馏煤焦油,得到苯、二甲苯等有机原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
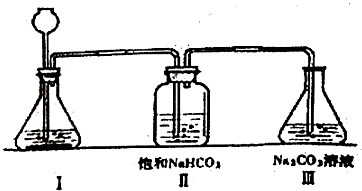
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| B. | 此时,B的平衡转化率是40% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 增大B,平衡向右移动B的平衡转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
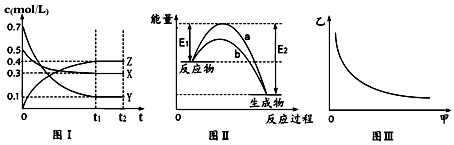
| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g),△H=-(E2-E1) | |
| B. | 若图Ⅲ中甲表示压强,乙表示Z的含量,其变化符合图Ⅲ中的曲线 | |
| C. | 若容器容积为10L,t1=10s,则前10s内的平均反应速率为v(Y)=0.006mol•L-1s-1 | |
| D. | 若该体系在373K下反应,则达到平衡所需时间小于t1,且达到平衡时c(X)>0.3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com