
| A.在标准状况下,1 mol任何物质的体积为22.4 L |
| B.等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度也相等 |
| C.1 mol H2和1 mol He中,所含的分子数相同、原子数相同,质量也相同 |
| D.体积为6 L的O2,其质量可能为8 g |
科目:高中化学 来源:不详 题型:填空题
| 实验操作 | 预期现象和结论 |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
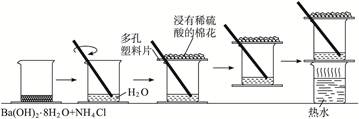
| 实验步骤 | 实验现象 | 得出结论 |
| 将晶体混合后立即用玻璃棒快速搅拌混合物 | 有刺激性气味的气体产生,该气体能使湿润的紫色石蕊试纸变蓝 | |
| 用手触摸烧杯下部 | 感觉烧杯变凉 | |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片(或小木板)粘到了烧杯底部 | |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上一会儿再拿起 | 玻璃片脱离上面烧杯底部 | |
| 反应完后移走烧杯上的多孔塑料Q片,观察反应物 | 混合物成糊状 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容量瓶中有少量水 |
| B.有少量KOH残留在烧杯中 |
| C.定容时俯视 |
| D.定容时仰视 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 | D.硫氰化钾溶液 |
| 同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | | |
| 第二种方法 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
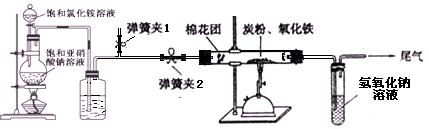 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
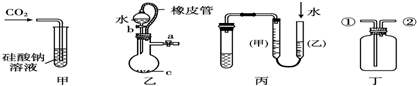
| A.甲装置:可用来证明碳的非金属性比硅强 |
| B.乙装置:橡皮管的作用是使水能顺利流下 |
| C.丙装置:用图示的方法不能检查此装置的气密性 |
| D.丁装置:从①口进气可收集二氧化碳,从②口进气可收集氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
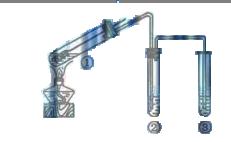
A.上下移动①中铜丝可控制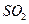 的量 的量 |
B.②中选用品红溶液验证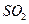 的生成 的生成 |
C.③中选用NaOH溶液吸收多余的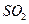 |
D.为确认 生成,向①中加水,观察颜色 生成,向①中加水,观察颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com