
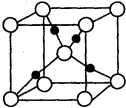
 已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.| 5+1-2×3 |
| 2 |
| 1 |
| 8 |
| 64×2+16 |
| NA |
2×
| ||
| ρ g?cm-3 |
| 288 |
| ρ NA |
| 3 |
| ||
| 3 |
| ||


科目:高中化学 来源: 题型:
| A、氨基酸是生命的基础,蛋白质是氨基酸的基石 |
| B、油脂碱性水解又称为皂化反应,因为油脂碱性水解后的产物为高级脂肪酸钠 |
| C、碘有“智力元素”之称,因为它是神经系统发育所不可缺少的 |
| D、维生素C药片的外面常包裹一层糖衣,因为维生素C具有还原性,易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄色变浅 | B、红色变深 |
| C、褪为无色 | D、黄色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
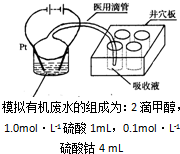 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、阳极上的电极反应均为2Cu-2e-+2OH-═Cu2O+H2O |
| B、工作过程中两个装置内溶液的pH均减小 |
| C、两个装置内阴离子均移向铜电极 |
| D、阴极上开始时均有氢气生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com