
| A. | c(H+) | B. | Ka(HF) | C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$ | D. | $\frac{c({H}^{+})}{c(HF)}$ |
分析 根据HF属于弱电解质,则在加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,并注意温度不变时,电离平衡常数不变来解答.
解答 解:A、因HF为弱酸,则浓度为0.1mol•L-1HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A错误;
B、因电离平衡常数只与温度有关,则Ka(HF)在稀释过程中不变,故B错误;
C、随着稀释的不断进行,c(H+)减小,c(OH-)不断增大,则的比值变小,故C错误;
D、因Ka(HF)=$\frac{c({F}^{-})c({H}^{+})}{c(HF)}$,当HF溶液加水不断稀释,促进电离,c(F-)不断减小,Ka(HF)不变,则$\frac{c({H}^{+})}{c(HF)}$增大,故D正确;
故选:D.
点评 本题考查弱电解质的稀释,明确稀释中电离程度、离子浓度、Ka的变化即可解答,水溶液中存在离子积常数,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①④⑤③②⑥ | B. | ④①③⑤②⑥ | C. | ⑤④③①②⑥ | D. | ③④⑤①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤①③⑥ | B. | ⑤④②①③⑥ | C. | ⑤④②③①⑥ | D. | ②④⑤③①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2O | B. | C3H6O3 | C. | C3H8O3 | D. | C3H6O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
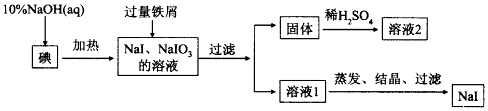
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一种“合成氨”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2.该反应过程与能量关系可用如图表示,完成反应的热化学方程式:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
一种“合成氨”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2.该反应过程与能量关系可用如图表示,完成反应的热化学方程式:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
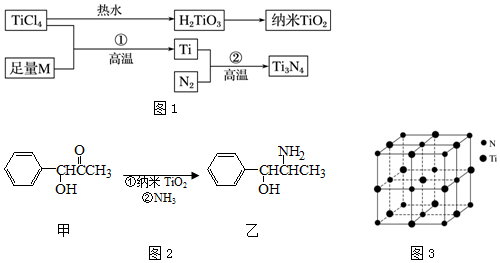
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
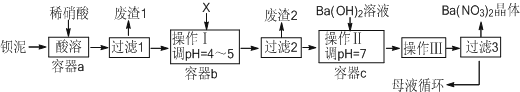
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com