
分析 已知Fe+2Fe3+═3Fe2+,根据反应可知Fe应为负极,失电子被氧化,正极可为C、Cu等,正极上Fe3+得电子生成Fe2+,电解质溶液含有Fe3+.
解答 解:已知Fe+2Fe3+═3Fe2+,根据反应可知Fe应为负极,失电子被氧化,负极反应为Fe-2e-═Fe2+,正极可为C、Cu等,碳棒为正极,正极上Fe3+得电子生成Fe2+,其电极反应为:2Fe3++2e-═2Fe2+,电解质溶液含有Fe3+,则电解质可为FeCl3,装置图为 ,
,
答:Fe为负极,碳棒为正极,正极反应为2Fe3++2e-═2Fe2+,负极反应为Fe-2e-═Fe2+,电解质为,FeCl3,装置图为 .
.
点评 本题考查了原电池的设计和工作原理的探究,为侧重于基础知识的考查,题目难度不大,注意把握原电池的组成和原理,学习中注意基础知识的积累.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:填空题
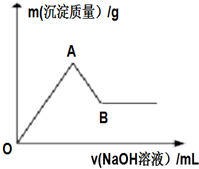 向100mlMgCl2 和 AlCl3的混合溶液,逐滴加入1mol/LNaOH溶液,如图:
向100mlMgCl2 和 AlCl3的混合溶液,逐滴加入1mol/LNaOH溶液,如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | 只有③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
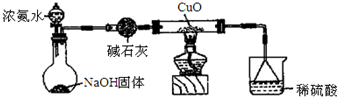
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
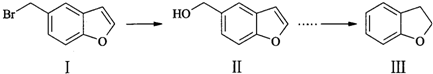
| A. | 可用FeCl3溶液鉴别化合物I和II | |
| B. | 物质I在NaOH醇溶液中加热可发生消去反应 | |
| C. | 物质II中所有原子可能位于同一平面内 | |
| D. | 物质III与足量H2加成所得产物分子中有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com