
分析 首先通过0.56LCO2,物质的量为:$\frac{0.56L}{22.4L/mol}$=0.025mol,可以知道碳酸镁有0.025mol,6.11g沉淀中有0.025mol 氢氧化镁,即1.45g,所以硫酸钡4.66g,物质的量为:0.02mol,而pH=12,所以氢氧根离子0.01mol/L,氢氧根离子为:0.01mol/L×0.2L=0.002mol,原有0.06mol氢氧根,减去氢氧化镁的0.05mol 氢氧根离子,再减去溶液中还剩下的0.002mol 氢氧根,剩下的0.008mol的氢氧根就是和多余的氢离子反应的,和碳酸镁反应的氢离子有0.05mol,因此总的氢离子0.058mol,结果是1.16mol/L,由此分析解答.
解答 解:首先通过0.56LCO2,物质的量为:$\frac{0.56L}{22.4L/mol}$=0.025mol,可以知道碳酸镁有0.025mol,6.11g沉淀中有0.025mol 氢氧化镁,即1.45g,所以硫酸钡4.66g,物质的量为:0.02mol,而pH=12,所以氢氧根离子0.01mol/L,氢氧根离子为:0.01mol/L×0.2L=0.002mol,原有0.06mol氢氧根,减去氢氧化镁的0.05mol 氢氧根离子,再减去溶液中还剩下的0.002mol 氢氧根,剩下的0.008mol的氢氧根就是和多余的氢离子反应的,和碳酸镁反应的氢离子有0.05mol,因此总的氢离子0.058mol,结果是1.16mol/L,
(1)原混合物中碳酸镁的质量0.025mol×84g/mol=2.1g,答:原混合物中碳酸镁的质量为2.1g;
(2)得到的沉淀中BaSO4的质量6.11g-1.45g=4.66g,答:得到的沉淀中BaSO4的质量为4.66g;
(3)因此总的氢离子0.058mol,所以盐酸的物质的量为:0.058mol,盐酸的物质的量浓度为$\frac{0.058mol}{0.05L}$=1.16mol/L,答:盐酸的物质的量浓度为1.16mol/L.
点评 本题考查混合物的有关计算,难度中等,清楚固体质量是什么成份是解题的关键,注意差量法的利用,学生要注意公式有应用.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | HI、HBr、HCl、HF | B. | HCl、H2S、PH3、SiH4 | ||
| C. | H2O、H2S、HCl、HBr | D. | H2O、HF、NH3、CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、R 的单质与稀盐酸反应速率 L<R | |
| B. | L 与 T 形成的化合物具有两性 | |
| C. | Q、T 两元素的氢化物热稳定性 Q<T | |
| D. | L、Q 形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
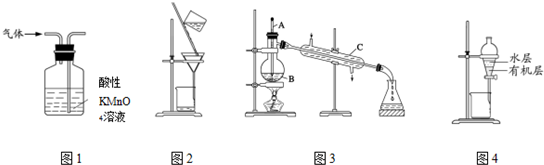
| A. | 用图1所示装置可除去甲烷中乙烯杂质 | |
| B. | 用图2所示装置分离硫酸铜溶液和铜 | |
| C. | 用图3所示装置分离乙醇和水 | |
| D. | 用图4所示装置分离苯萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
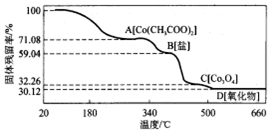
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ②③ | C. | ①④⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
在一密闭容器中,反应aA(g) 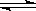 bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向正反应方向移动了
B.物质A的转化率增大了
C.物质B的质量分数增加了
D.a >b
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


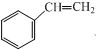




查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com