
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(容器体积不变),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),下列事实能说明该分解反应达到化学平衡状态的是( )
2NH3(g)+CO2(g),下列事实能说明该分解反应达到化学平衡状态的是( )
A.2v正(NH3)=v逆(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的平均摩尔质量不变
D.密闭容器中氨气的体积分数不变
科目:高中化学 来源: 题型:
【题目】化学反应A(g)+3B(g)![]() 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
A.v(A)=0.20 mol·(L·min)-1B.v(B)=0.45 mol·(L·s)-1
C.v(C)=0.30 mol·(L·min)-1D.v(D)=0.35 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水资源非常重要,联合国确定2003年为国际淡水年.海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程![]() 又称海水脱盐
又称海水脱盐![]() ,其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等.下列方法中也可以用来进行海水淡化的是
,其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等.下列方法中也可以用来进行海水淡化的是
A.过滤法B.蒸馏法C.萃取法D.蒸发法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,某气体X可能由H2、CO、CH4中的一种或几种组成。将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题:
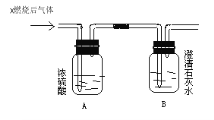
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是____________。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是____________。
(3)若A、B两个洗气瓶的质量都增加,则气体X可能是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷和氯气反应生成PCl3的热化学方程式为P4(白磷,g)+6Cl2(g)═4PCl3(g) ΔH=-1326kJ·mol-1,已知化学键键能为Cl—Cl键243kJ·mol-1,P—Cl键331kJ·mol-1。白磷和PCl3的分子结构如图所示,则P—P键的键能为( )

A.396kJ·mol-1B.198kJ·mol-1
C.99kJ·mol-1D.49.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g) ΔH>0在一密闭容器中进行,则下列说法或结论中,能够成立的是( )
CO(g)+H2(g) ΔH>0在一密闭容器中进行,则下列说法或结论中,能够成立的是( )
A.其他条件不变,仅将容器的体积缩小一半,v正减小而v逆增大
B.其他条件不变,升高温度,v正、v逆均增大且H2O(g)转化率增大
C.保持容器体积不变,充入少量He使体系压强增大,v正、v逆均增大
D.其他条件不变,适当增加C(s)的质量,v正增大而v逆减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某10mL溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,向溶液中逐滴加入![]() 的盐酸,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中正确的是( )
的盐酸,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中正确的是( )

A.原溶液肯定含有OH-、CO32-、AlO2-、SiO32-、Na+
B.若原溶液中只含有某一种阳离子(不考虑水电离出的氢离子)且忽略反应前后溶液体积变化,那么该离子在原溶液中的物质的量浓度为![]() mol/L
mol/L
C.n(CO32-):n(AlO2-)=3:4
D.a值肯定等于4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)2SO3(g) △H<0;
(1)写出该反应的化学平衡常数表达式K=__________
(2)降低温度,该反应K值__________,二氧化硫转化率___________,化学反应速率___________(以上均填增大、减小或不变)。

(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态时间是___________________________。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是_______________________(用文字表达)。
(5)10min到15min的曲线变化的原因可能是____________(填写编号)。
A、加了催化剂 B、缩小容器体积
C、降低温度 D、增加SO3的物质的量。
(6)若该反应的密闭容器为2L,则反应15min时,v(SO2)=___________
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是(____)
A、及时分离出SO3气体B、适当升高温度
C、增大O2的浓度 D、选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com