
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.碳原子核外电子有六种运动状态 | B.NH4+中N原子轨道杂化类型为sp3 |
| C.电负性:O > Cl | D.第一电离能 Al > Mg |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.W、Y、Z的电负性大小顺序一定是Z>Y>W |
| B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z |
| C.Y、Z形成的分子的空间构型可能是正四面体 |
| D.WY2分子中σ键与π键的数目之比是2:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.它们从上到下的非金属性向金属性递变的趋势比卤族元素明显 |
| B.碳族元素的气态氢化物的稳定性从上到下逐渐减弱 |
| C.碳族元素原子的最外层都有4个电子 |
| D.主要化合价有+2价和+4价,大多数+2价化合物稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
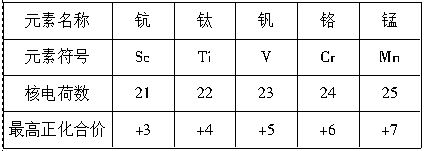
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com