
【题目】在0.10mol·L-1NH3·H2O溶液中,加入少量NH4Cl晶体后,引起的变化是
A.NH3·H2O的电离程度减小
B.NH3·H2O的电离常数增大
C.溶液的导电能力不变
D.溶液的pH增大
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】化学农药是用化学方法合成的一大类物质,有杀虫剂、杀菌剂、除草剂和植物生长调节剂等。下列关于甲酯除草醚 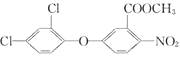 的叙述正确的是( )
的叙述正确的是( )
A.该物质的分子式为:C14H8O5NCl2
B.该物质易溶于水
C.该物质能发生水解反应、加成反应、消去反应
D.1 mol该物质在一定条件下能与5 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究实验富制氯气过程中反应物与生成氯气之间量的关系.设计了如图所示的装置 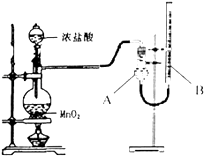
(1)装置A的名称是
(2)该实验装置检查气密性的方法是
(3)如果将过二氧化锰与20mL12mol/L的盐酸混合加热,充分反应后收集到的氯气少于0.06mol,其可能原因有
a.加热使浓盐酸放出大量HCl
b.盐酸变稀后不发生该反应
c.烧瓶中残留有氯气
d.装置B中液面高于A.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素 R 有某种同位素的氯化物 RClX,该氯化物中 R 微粒核内中子数为 Y,核外电子数为 Z,该同位素的符号为
A. YZRB. Y+X+ZX+ZRC. YZ+XRD. Y+XZR
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸,反应式为:
主反应:
副反应:![]()
主要物料的物理常数如表:
名称 | 分子量 | 性状 | 相对密度 | 沸点 | 溶解度 | |
水 | 乙醚 | |||||
苯甲醛 | 106 | 无色液体 | 1.04 | 179 | 微溶 | 易溶 |
苯甲酸 | 122 | 无色晶体 | 1.27 | 249 | 0.21g | 66g |
苯甲醇 | 108 | 无色液体 | 1.04 | 205 | 微溶 | 易溶 |
乙醚 | 74 | 无色液体. | 0.71 | 35 | 不溶 | ﹣﹣ |
实验步骤: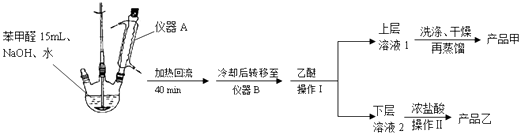
(1)仪器A的作用是 .
(2)蒸馏操作时温度应该控制在左右.获得产品乙时进行的操作Ⅱ的名称是 .
(3)①上层溶液1中除乙醚外主要有机杂质是、 .
洗涤时先后用到了饱和NaHSO3溶液、10%的NaHCO3溶液和水.
②洗涤操作在中进行.
a.烧杯 b.布氏漏斗 c.烧瓶 d.分液漏斗
③加入10%的NaHCO3溶液至(填现象)时说明杂质已被除尽.
(4)若产品甲的质量为5.40g,则产品甲的产率是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸具有很强的腐蚀性,化学实验时一定要特别注意安全。如果不慎有少量浓硫酸沾到皮肤上,必须迅速用大量的水冲洗,然后再涂上( )
A.3%~5%的碳酸氢钠溶液B.2%~5%的硼酸溶液
C.5%~10%的氢氧化钠溶液D.5%~10%的稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学进行了FeCl2溶液的配制、浓度的测定以及Fe2+还原性的实验,并针对异常现象进行探究.
(1)步骤一:制取FeCl2 甲同学准备用两种方案制取.
方案1:按如图装置用H2还原无水FeCl3制取.
E中盛放的试剂是;D中反应的化学方程式为 . 此方案有个明显的缺陷是 .
方案2:由0.1molL﹣1 FeCl3溶液制取FeCl2溶液,你认为其操作应该是 .
(2)步骤二:测定方案2所配FeCl2溶液的物质的量浓度.用重铬酸钾法(一种氧化还原滴定法)可达到目的.若需配制浓度为0.01000molL﹣1的K2Cr2O7标准溶液480mL,实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少 ,
本实验滴定过程中操作滴定管的图示正确的是(填编号).
下列错误的操作使测定的FeCl2溶液浓度偏小的是
A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势
B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失.
C.锥形瓶洗净后未干燥
(3)步骤三:向2mL FeCl2溶液中滴加2滴0.1molL﹣1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5molL﹣1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
甲同学探究“步骤三”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀,并测得生成了两种可直接排放到空气中的气体.
实验III.向2mL 0.1molL﹣1 FeCl3溶液中滴加2滴0.1molL﹣1KSCN溶液,变红,通入O2 , 无明显变化.
①实验I说明溶液红色褪去是因为SCN﹣发生了反应而不是Fe3+发生反应.
②实验III的目的是 .
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN﹣氧化成SO42﹣和相关气体.写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰毒有剧毒,人体摄入后将严重损害心脏、大脑组织甚至导致死亡,严禁吸食。它的分子式为C10H15N,其中的氮元素在周期表中处于
A. 第IIA族 B. 第IIIA族 C. 第IVA族 D. 第VA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色.丙池中盛有100mL3.00molL﹣1的CuSO4溶液.试回答下列问题: 
(1)在电源中,B电极为极(填电极名称,下同);乙装置中粗铜为极.
(2)在甲装置中,石墨(C)电极上发生反应(填“氧化”或“还原”);甲装置中总的化学方程式是 .
(3)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为L.
(4)在丙装置中,X电极上发生的电极反应式是 .
(5)在此过程中,若丙池中两电极产生的气体恰好相等时,理论上在乙池中精铜增加了g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com