
 春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.
春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.科目:高中化学 来源: 题型:解答题
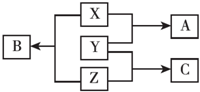 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g氮气含有的原子数为NA | |
| B. | 标准状况下22.4L水中含有的水分子数为NA | |
| C. | 1molOH-含有的电子数为10NA | |
| D. | 0.1L 1mol/L NaCl溶液中含有Na+个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

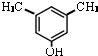 或
或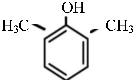 .
.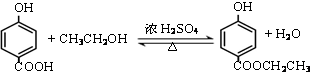 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
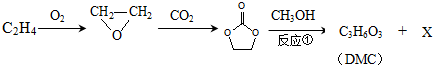
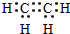 ;石油工业上获得C2H4的操作名称为:石油裂解
;石油工业上获得C2H4的操作名称为:石油裂解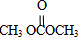

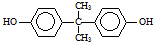 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: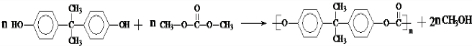 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com