
| A. | 2H2(g)+O2(g)=2H2O(l)△H<0 | B. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H<0 | ||
| C. | HCl(aq)+NaOH (aq)=NaCl(aq)+H2O(l)△H<0 | D. | 4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe (OH)3(s)△H<0 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ClCH2COOH的酸性比CH3COOH酸性强 | |
| B. | 苯酚能与NaOH溶液反应而乙醇则很难 | |
| C. | HOOCCH2CHO既能发生银镜反应又能发生酯化反应 | |
| D. | 丙酮(CH3COCH3)中的氢原子比乙烷中的氢原子更易发生卤代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 | |
| B. | 甲烷、苯、乙酸都可以发生取代反应 | |
| C. | 标况下,1mol 乙醇可与足量的Na反应生成22.4LH2 | |
| D. | 乙酸可与Na2CO3溶液反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
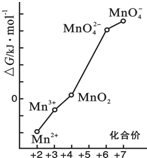 不同价态锰的微粒的能量(△G)如图.若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒.
不同价态锰的微粒的能量(△G)如图.若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知反应AsO43-+2I-+H+?AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:
已知反应AsO43-+2I-+H+?AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1:c2=1:3 | B. | 平衡时,Y与Z的生成速率之比为3:2 | ||
| C. | X、Y的转化率不相等 | D. | c1的取值范围0<c1<0.14 molL-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com