
等物质的量的SO2和SO3相比较,下列结论错误的是
A.它们的分子数目之比为1∶1 B.它们的氧原子数目之比为2∶3
C.它们的质量之比为1∶1 D.它们所含原子数目之比为3∶4
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高一上阶段考二化学卷(解析版) 题型:选择题
在含有1molFeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀得到的固体物质是
A.Fe B.FeO C.Fe(OH)3 D.Fe2O3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁师大附中高二12月月考化学试卷(解析版) 题型:选择题
下列化合物中既可发生取代反应,也可发生加成反应,还能使KMnO4酸性溶液褪色的是( )
A. 乙烷 B. 乙醇 C. 丙烯 D. 苯
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上期中化学卷(解析版) 题型:选择题
在强酸性溶液中能大量共存,且溶液为无色透明的离子组是
A.Na+、Al3+、SO42—、NO3- B.Ba2+、Na+、SO42—、NO3-
C.K+、Mg2+、MnO4—、SO42—、 D.K+、Na+、NO3- 、HCO3-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上期中化学卷(解析版) 题型:选择题
金属钠与下列溶液反应时,既有白色沉淀析出又有气体逸出的是
A.BaCl2溶液 B.K2SO4溶液 C.KCl溶液 D.Ca(HCO3)2溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第二次考试化学卷(解析版) 题型:填空题
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,试回 答下列问题:
答下列问题:
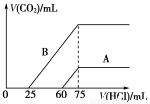
(1)原NaOH溶液的物质的量浓度为____________mol/L。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是____________,其物质的量之比为__________。
(3)曲线B表明,所得溶液加盐酸后产生CO2气体体积(标况)的最大值为 mL。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第二次考试化学卷(解析版) 题型:选择题
浓H2SO4 密度1.84g/mL,物质的量浓度为18.4mol/L,质量分数为98%,取10mL浓H2SO4和a mL水混合得物质的量浓度为C mol/L,质量分数为b%.下列组合正确的是
(1)若C=9.2则a>10 b>49%
(2)若C=9.2则a>10 b<49%
(3)若b=49则a=18.4 C<9.2
(4)若b=49则a=18.4 C>9.2.
A.(1)(3) B.(1)(4) C.(2)(3) D.(2)(4)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:填空题
( 14分)
I .(1)已知H2的燃烧热285.8KJ/mol,写出液态水电解生成H2和O2的热化学方程式 ;
(2)已知2SO2(g)+O2(g) = 2SO3(g) ΔH=-197 kJ/mol,相同温度和压强条件下,4molSO2和2molO2充入容器中反应至平衡时放出的能量为Q KJ,则Q 394KJ(填“>”“<”或“=”)
II.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g) CH3OH
CH3OH (g)+H2O(g) ΔH1
(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
(1)由表中数据判断ΔH2 0(填“>”、“<”或“=”),
(2)若容器容积不变,下列措施可增加甲醇产率的是 ,
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.恒温恒容充入He,使体系总压强增大
E.按原比例再充入 CO和 H2
(3)某温度下,将2 mol CO和6 mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择);
(4)恒温下,1mol CO和nmol H2在一个容积可变的密闭容器中反应达到平衡后,生成a molCH3OH.若起始时放入3molCO+3nmolH2,则达平衡时生成CH3OH_______mol。
查看答案和解析>>
科目:高中化学 来源:2017届湖南师大附中高三上月考四化学试卷(解析版) 题型:实验题
某化学小组的同学模拟工业制硝酸设计了如下图所示的装置。已知:
CaCl2+nH2O→CaCl2·nH2O;CaCl2+8NH3→[Ca(NH3)8]Cl2,根据题意完成下列填空:

(1)分液漏斗中氨水的浓度为9.0 mol/L。现用质量分数为35%、密度为0.88 g/cm3的氨水配制9.0 mol/L的氨水100 mL,需要的定量仪器有 (选填编号)。
a.100 mL容量瓶 b.10 mL量筒 c.50 mL量筒 d.电子天平
(2)受热时,乙中反应的化学方程式为 。
(3)实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,可观察到的现象有 。
(4)干燥管甲的作用是 ;丙中盛放的药品为 (选填下列编号),其目的是 。
a.浓H2SO4 b.无水CaCl2 c.碱石灰 d.无水CuSO4
(5)丁中除了NO之外,还可能存在的气体有 (填写化学式)。烧杯中发生反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com