
| A、过滤 | B、蒸馏 |
| C、分液 | D、纸上层析 |
科目:高中化学 来源: 题型:
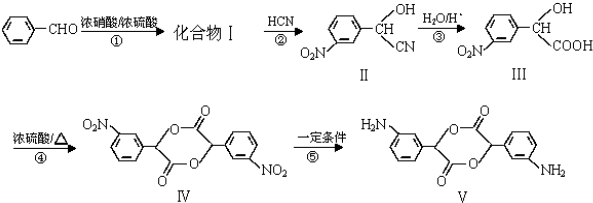
| 一定条件 |
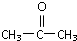 )代替化合物 I发生反应②和反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),则化合物Ⅵ的结构简式为
)代替化合物 I发生反应②和反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),则化合物Ⅵ的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
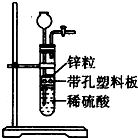 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④苯⑤Na2C03溶液⑥KCl溶液.( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④苯⑤Na2C03溶液⑥KCl溶液.( )| A、①②③ | B、②④⑤ |
| C、①②④⑥ | D、②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
主族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 元 素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中,溶液紫色褪去 | 证明SO2具有漂白性 |
| B | 先加入AgNO3溶液,再加稀硝酸 | 检验Na2SO4溶液中含有Cl- |
| C | 向1mL0.2mol?L-1NaOH溶液中滴入2滴0.1mol?L-1的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol?L-1的FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下,氢氧化镁的溶解度大于氢氧化铁的溶解度 |
| D | 测定Na2SO4溶液与Na2CO3溶液的酸碱性 | 证明非金属性S>C |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
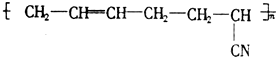 具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )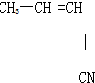
| A、③⑥ | B、②③ | C、①③ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
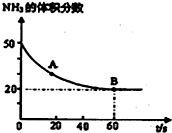 氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害.
氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com