
| A. | 常温下干燥的Cl2能用钢瓶贮运 | |
| B. | 检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 | |
| C. | 自然界中不存在游离态硅 | |
| D. | HF溶液不能贮存在磨口玻璃塞的试剂瓶中 |
分析 A、氯气与铁在点燃条件下反应;
B、氯化氢、氯气都和硝酸银溶液反应;
C、硅是亲氧元素在自然界中不存在游离态的硅;
D、氢氟酸与二氧化硅反应生成四氟化硅.
解答 解:A、氯气与铁在点燃条件下反应,但常温下干燥的氯气与铁不反应,故A正确;
B、氯气和水反应生成盐酸和次氯酸,氯化氢和硝酸银反应生成氯化银沉淀,所以氯气、氯化氢都能和硝酸银溶液反应生成白色沉淀,所以硝酸银溶液不能用于检验HCl气体中是否混有Cl2,故B错误;
C.硅为亲氧元素,在自然界中主要以二氧化硅和硅酸盐的形式存在,故C正确;
D、氢氟酸与二氧化硅反应生成四氟化硅,所以HF溶液不能贮存在磨口玻璃塞的试剂瓶中,故D正确;
故选B.
点评 本题综合考查元素及其化合物的性质,为高考高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
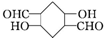 )
)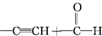 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$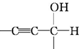
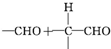 $\stackrel{稀NaOH}{→}$
$\stackrel{稀NaOH}{→}$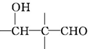
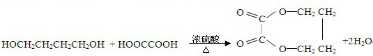 (注明条件).
(注明条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:Z>Y>X | B. | 单质密度:Y>X>Z | ||
| C. | 离子半径:X2->Z->Y+ | D. | 原子序数:X>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
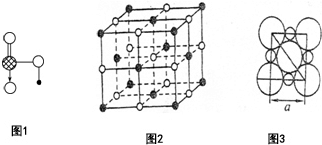 (1)Na、Cu、Si、H、C、N六种元素,其对应单质的熔点按照A、B、C、D、E、F的顺序依次升高,其中C、D均是热和电的良导体.
(1)Na、Cu、Si、H、C、N六种元素,其对应单质的熔点按照A、B、C、D、E、F的顺序依次升高,其中C、D均是热和电的良导体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有1个双键的直链有机物 | B. | 含2个双键的直链有机物 | ||
| C. | 含1个双键的环状有机物 | D. | 含一个叁键的直链有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 NaCl NaOH | B. | NaOH NaCl Na2CO3 | ||
| C. | NaCl NaOH Na2CO3 | D. | NaCl Na2CO3 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应选用球形分液漏斗进行分液,使用前要检查是否漏水 | |
| B. | 将混合液倒入分液漏斗,塞紧玻璃塞,上下振荡 | |
| C. | 混合液摇匀后,立即将分液漏斗放在铁圈上静置,分层 | |
| D. | 打开分液漏斗的玻璃塞,再打开旋塞,使下层液体从分液漏斗下端放出,待下层液体完全流出后关闭旋塞,把上层液体从分液漏斗上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com