
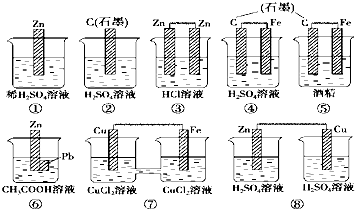
| A. | ①③④ | B. | ④⑦ | C. | ④⑥⑦ | D. | ①⑦⑧ |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,据此进行解答.
解答 解:①该装置只有一个电极材料,所以不能形成原电池,故①错误;
②该装置只有一个电极材料,且石墨和电解质溶液不能自发的进行氧化还原反应,所以不能形成原电池,故②错误;
③两电极材料相同,所以不能形成原电池,故③错误;
④该装置符合原电池的构成条件,所以能形成原电池,故④正确;
⑤酒精不是电解质,铁和酒精不能自发的进行氧化还原反应,所以不能形成原电池,故⑤错误;
⑥该装置符合原电池的构成条件,所以能形成原电池,故⑥正确;
⑦该装置符合原电池的构成条件,所以能形成原电池,故⑦正确;
⑧该装置两电极间不能构成闭合回路,所以不能形成原电池,故⑧错误;
故选C.
点评 本题考查了原电池的构成条件,题目难度不大,明确原电池的构成条件为解答关键,注意这几个条件必须同时存在才能形成原电池,缺一不可,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
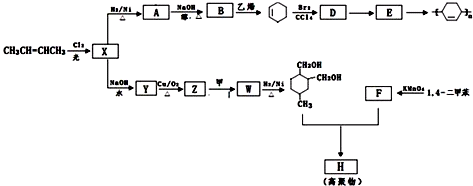
 (或写成
(或写成 R代表取代基或氢)
R代表取代基或氢) .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol水的体积约是22.4升 | |
| B. | 1molH2所占的体积约是22.4升 | |
| C. | 标准状况下,6.02×1023个分子所占的体积约是22.4升 | |
| D. | 标准状况下,28g氮气和CO的混合气体的体积约是22.4升 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na>Mg | B. | 热稳定性:HF>HCl | ||
| C. | 酸性:H2SO3>H2CO3 | D. | 氧化性:O2>S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com