
| A. | 直接加碱,调整溶液pH≥9.6 | |
| B. | 加足量的铜粉,将Fe2+还原出来 | |
| C. | 加足量的锌粉,将Fe2+还原出来 | |
| D. | 先将Fe2+氧化成Fe3+,再调整pH在3~4 |
分析 pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可先氧化亚铁离子,以此来解答.
解答 解:A.直接加碱,调整溶液pH≥9.6,离子均转化为沉淀,不能除杂,故A不选;
B.加足量的铜粉,不能将Fe2+还原出来,故B不选;
C.加足量的锌粉,将Fe2+还原出来,但引入新杂质锌离子,故C不选;
D.将Fe2+氧化成Fe3+,再调整pH在3~4,只有铁离子转化为沉淀,可除杂,故D选;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握混合物分离提纯、物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:填空题
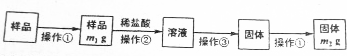
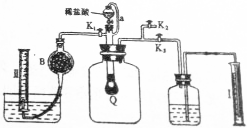
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
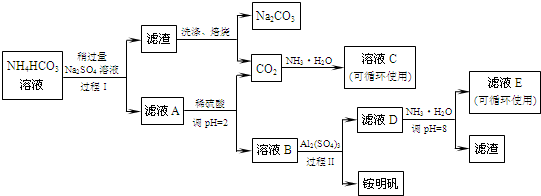
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
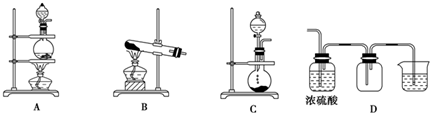
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.0mol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+2 c(CO32-)=1.0mol/L | |
| B. | 1.0mol/L Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其它条件不变时,使用高效催化剂,不可以使NO的转化率增大 | |
| B. | 平衡时,其它条件不变,充入NH3,平衡向右移动,NH3的转化率增大 | |
| C. | 当混合气体的密度不变了,则反应达到化学平衡状态 | |
| D. | 平衡时,其它条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com