
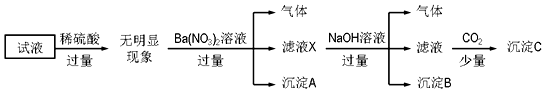
| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| C. | 沉淀C为Al(OH)3 | |
| D. | 无法确定原试液中是否含有K+、Cl- |
分析 加入过量稀硫酸无明显变化,说明无碳酸根离子,无Ba2+,无AlO2-;
加入硝酸钡有气体,说明有亚铁离子存在且被氧化,沉淀为硫酸钡;
加入NaOH有气体,说明存在铵根离子,气体氨气,沉淀B为红褐色氢氧化铁沉淀;
通入少量CO2产生沉淀,先与OH-、Ba2+反应,沉淀C为碳酸钡,不能说明存在Al3+.
因为存在的离子浓度均为0.1mol•L-1,从电荷的角度出发,只能含有NH4+、Fe2+、Cl-、SO42-才能保证电荷守恒,K+必然不能存在.
解答 解:加入过量稀硫酸无明显变化,说明无碳酸根离子,无Ba2+,无AlO2-;
加入硝酸钡有气体,因为前面已经加入了硫酸,硝酸根离子在酸性条件下具有强氧化性,说明有亚铁离子存在且被氧化,沉淀为硫酸钡;
加入NaOH溶液有气体生成,说明存在铵根离子,气体为氨气,沉淀B为红褐色氢氧化铁沉淀;
通入少量CO2产生沉淀,先与OH-、Ba2+反应,沉淀C为碳酸钡,不能说明存在Al3+;
因为存在的离子浓度均为0.1mol•L-1,从电荷的角度出发,只能含有NH4+、Fe2+、Cl-、SO42-才能保证电荷守恒,K+必然不能存在,故B、C、D错误,A正确,
故选A.
点评 本题考查了常见离子的性质检验,注意硝酸根离子在酸性条件下具有强氧化性,另外本题需要根据电荷守恒判断氯离子是否存在,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 编号 | A | B | C | D |
| 实验装置或 方案 | 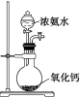 | 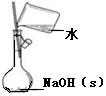 | 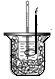 50mL0.5mol/LHCl与50mL0.55mol/LNaOH溶液 |  |
| 目的 | 制备少量氨气 | 配制0.10mol/L NaOH溶液 | 测定中和热 | 探究Ksp(AgCl)与Ksp(AgI)的大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质C表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 反应开始到2 s,物质B的物质的量浓度减少了0.85 mol/L | |
| C. | 2 s时物质A的转化率为15% | |
| D. | 2v(A)=v(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
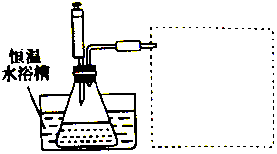 某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:| 实验序号 | 参加反应的物质 | 收集amL(在标准状况下)O2所需时间/s | ||||
| 酸性Fe2(SO4)3溶液 | H2O2溶液 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 4 | 0.1 | 3 | 4 | 3 | t1 |
| ② | 4 | 0.1 | 2 | 4 | V1 | 5 |
| ③ | V2 | 0.1 | V3 | 4 | 2 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
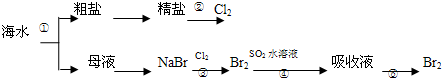
| A. | 上述工艺流程中涉及到化合、分解、复分解和置换反应 | |
| B. | ①只发生了化学变化,②是工业上用电解熔融NaCl制备Cl2 | |
| C. | ③④涉及的反应均为氧化还原反应,⑤只需要蒸馏即可得到单质Br2 | |
| D. | ④中反应的离子方程式为SO2+Br2+2H2O═4H++SO42-+2Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 制取Fe(OH)2的装置及操作 | |
| B. | 某溶液用盐酸酸化后再滴加硝酸钡溶液,检验溶液中是否含有SO42- | |
| C. | 向滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去,可证明Na2CO3溶液显碱性是由于CO32-水解造成的 | |
| D. | 将氯化铁饱和滚液与稀氨水混合,加热至沸腾,制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则向含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol | |
| D. | 保持其它条件不变,如升高温度,D的体积分数增大,说明该反应的△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com