

分析 (1)依据给出的热化学方程式利用盖斯定律计算反应热;
(2)根据化学方程式Mg(AlH4)2═MgH2+2Al+3H2↑计算;
(3)根据LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0,欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,据此分析;
(4)①依据平衡常数表达式解答;
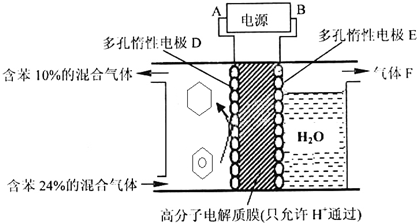
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷.
解答 解:(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(g)═2Mg(s)+Mg2NiH4(s)△H3 =-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6KJ/mol,则△H3=+84.6KJ/mol,
故答案为:+84.6;
(2)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,从方程式可知反应中每转移6mol电子时生成3mol,所以反应中每转移3mol电子时产生的H2的物质的量为1.5,生成氢气33.6L;
故答案为:33.6;
(3)欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,由LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0为气体减小的放热反应,所以可以升高温度或降低压强,平衡向逆向移动;
故答案为:bc;
(4)①环己烷的起始浓度为amol•L-1,平衡时苯的浓度为bmol•L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=$\frac{C(C{\;}_{6}H{\;}_{6})C{\;}^{3}(H{\;}_{2})}{C(C{\;}_{6}H{\;}_{12})}$=$\frac{27{b}^{4}}{a-b}$ mol3•L-3;
故答案为:$\frac{27{b}^{4}}{a-b}$ mol3•L-3;
该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,电解池阴极与电源负极相连,得出电解过程中产生的气体F为O2,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:负; O2;C6H6+6H++6e-=C6H12.
点评 本题考查了盖斯定律的应用、化学平衡的移动、平衡常数的计算及其电解池原理等知识点,题目难度较大,注意对相关知识的理解.


科目:高中化学 来源: 题型:选择题
| A. | 要检验溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 要检验蔗糖的水解产物,将蔗糖的水解液加入到新制的氢氧化铜悬浊液中,加热至沸腾观察是否有红色沉淀产生 | |
| C. | 在进行溴乙烷与NaOH乙醇溶液反应的实验中,将反应产生的气体直接通入到酸性高锰酸钾溶液中来检验产生的气体是否为乙烯 | |
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,铜丝恢复成原来的红色,取出,铜丝又会变为黑色,反复几次,用氢氧化铜悬浊液可以证明是否生成了乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
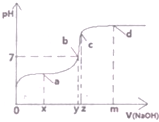 (1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.
(1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.
C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CuSO4溶液将ZnS转化成CuS沉淀:S2-+Cu2+═CuS↓ | |
| B. | NH4HCO3溶液与过量NaOH溶液混合加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向酸化的FeSO4溶液中滴入少量H2O2溶液:H2O2+2Fe2++2H+═2Fe3++2H2O | |
| D. | 用惰性电极电解饱和的KCl溶液:2H++2Cl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com