
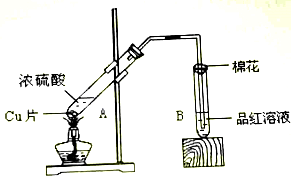
分析 (1)加热条件下,浓硫酸和Cu发生氧化还原反应生成硫酸铜、二氧化硫和水;
(2)该反应中Cu元素化合价由0价变为+2价,硫酸中S元素化合价由+6价变为+4价,根据转移电子守恒计算被还原硫酸物质的量.
解答 解:(1)加热条件下,浓硫酸和Cu发生氧化还原反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O;
(2)该反应中Cu元素化合价由0价变为+2价,硫酸中S元素化合价由+6价变为+4价,有1molCu参加反应转移2mol电子,根据转移电子守恒知,反应中n(Cu)=n[H2SO4(被还原)]=1mol,
故答案为:1mol.
点评 本题以浓硫酸和铜的反应为载体考查化学方程式的计算及浓硫酸的性质,正确书写方程式是解本题关键,知道该反应中浓硫酸的作用,利用转移电子守恒进行计算,也可以根据方程式计算,题目难度不大.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:解答题

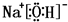 或
或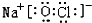 等
等查看答案和解析>>
科目:高中化学 来源: 题型:选择题
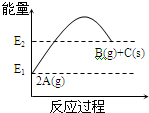
| A. | 1molC(s)的能量高于2molA(g)能量 | |
| B. | 该反应的热化学方程式为:2A(g)═B(g)+C(s)△H=(E1-E2)kJ/mol | |
| C. | 反应过程中当v(A)=0.4mol/(L•s),则v(C)=0.2mol/(L•s) | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al元素被还原 | |
| B. | Al2O3是氧化产物 | |
| C. | Fe2O3既是氧化剂又是还原剂 | |
| D. | 每生成1molFe时,转移电子的物质的量为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
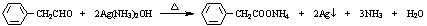 .
.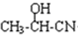 $→_{H_{2}O}^{HCI}$
$→_{H_{2}O}^{HCI}$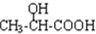 ,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色.
,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色. ;
;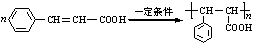 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
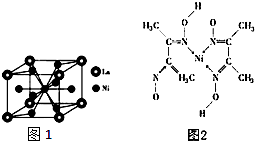 镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛.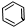 、④HCHO其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;
、④HCHO其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com