
分析 Ⅰ、(1)NaHCO3溶液中存在HCO3-的电离和水解方程,及水的电离方程;
(2)根据溶液的溶质及存在的平衡方程分析;
(3)NaHCO3溶液呈碱性HCO3-的水解程度大于电离程度;
(4)HCO3-与Al3+发生相互促进的水解,生成二氧化碳和氢氧化铝沉淀;
II、(1)如果酸是强电解质,一元酸的浓度与氢离子浓度相等,二元酸的浓度为氢离子浓度的一半;如果酸是弱电解质,一元酸的浓度大于氢离子浓度;
中和一定量NaOH溶液生成正盐时,酸的浓度相等时,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半;
(2)稀释浓度相等的酸,促进弱电解质电离;
III、氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,当溶液中氯离子浓度增大时,银离子浓度会减小;依据溶度积分别计算.
解答 解:Ⅰ、(1)NaHCO3溶液中存在HCO3-的电离和水解方程,及水的电离方程,所以溶液中的平衡方程式有:HCO3-?H++CO32-,HCO3-+H2O?H2CO3+OH-,H2O?H++OH-;
故答案为:①HCO3-?H++CO32-,②HCO3-+H2O?H2CO3+OH-,③H2O?H++OH-;
(2)NaHCO3溶液中存在HCO3-?H++CO32-,HCO3-+H2O?H2CO3+OH-,H2O?H++OH-,所以溶液中的微粒有HCO3-、H+、CO32-、H2CO3、H2O、OH-、Na+,则溶液中共有7中微粒;
故答案为:7;
(3)NaHCO3溶液呈碱性,HCO3-的水解程度大于电离程度,所以该溶液中的离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(4)HCO3-与Al3+发生相互促进的水解,生成二氧化碳和氢氧化铝沉淀,其反应的离子方程式为:3HCO3-+Al3+═Al(OH)3↓+3CO2↑;
故答案为:3HCO3-+Al3+═Al(OH)3↓+3CO2↑;
II、(1)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以氢离子浓度其大小顺序为b>a>c;
中和一定量NaOH溶液生成正盐时,酸的浓度相等,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半,所以三种酸的体积大小关系是V2>V1=V3;
故答案为:b>a>c;V2>V1=V3;
(2)硫酸是二元强酸,盐酸是一元强酸,醋酸是一元弱酸,PH相等的三种酸,氢离子浓度相等,加水稀释促进醋酸电离,所以稀释后溶液中氢离子浓度①=②<③,则溶液中pH1=pH2>pH3,
故答案为:pH1=pH2>pH3;
III、Ksp=1.8×10-10mol2•L-2=C(Ag+)•C(Cl-),通过计算分别得到:①100mL蒸馏水中含银离子浓度和氯离子浓度相同;②100mL 0.2mol•L-1AgNO3溶液中Ag+浓度为0.3mol/l抑制沉淀溶解平衡,c(Cl-)=6×10-10mol/L;③100mL0.1mol/L MgCl2溶液中氯离子浓度为0.2mol/L,银离子浓度=9×10-10mol/L;综上所述c(Ag+)由大小顺序为:②①③;②中氯离子的浓度6×10-10 mol/L;
故答案为:②①③;6×10-10mol/L.
点评 本题考查了盐的水解、水解方程和电离方程是书写、溶液中离子浓度的关系、弱电解质的电离、Kp的应用等,侧重于反应原理的应用的考查,题目综合性较强,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:推断题
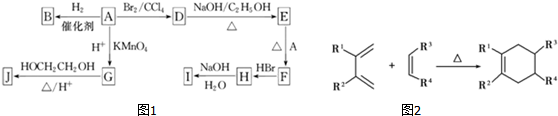
 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
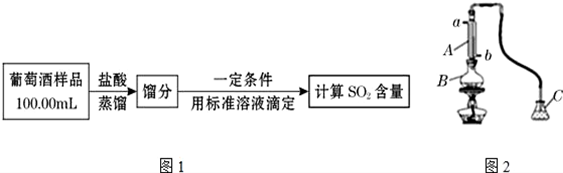
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
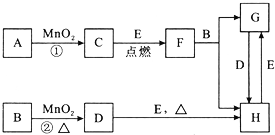
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
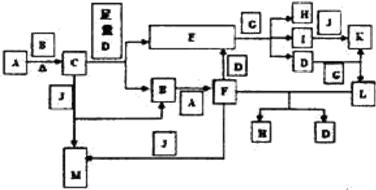
科目:高中化学 来源: 题型:推断题
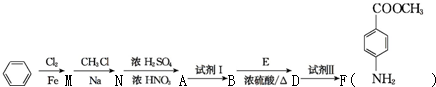
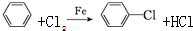
 苯胺(弱碱性,易氧化)
苯胺(弱碱性,易氧化)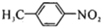 .
.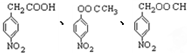 任意2种.
任意2种.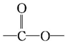 结构.
结构.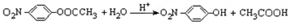 .
.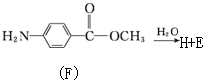 化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域.请写出该缩聚反应的化学方程式
化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域.请写出该缩聚反应的化学方程式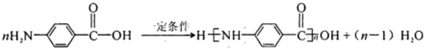 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84消毒液具有碱性,可用作消毒剂和漂白剂 | |
| B. | 氢氟酸具有酸性,可用于玻璃的腐蚀剂 | |
| C. | 过氧化钠具有漂白性,可作航空和潜水的供氧剂 | |
| D. | 活性铁粉具有还原性,在食品袋中可用作除氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D、E两种元素仅可组成化学式为E2D的化合物 | |
| B. | 原子半径:E>F>C>D | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性:D>C>F>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01 mol/(L•s) | B. | v(NO)=0.08 mol/(L•s) | ||
| C. | v(H2O)=0.003 mol/(L•s) | D. | v(NH3)=0.001 mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com