
ŌŖĖŲ±ąŗÅ | a | b | c | d | e | f | g | h |
Ō×Ó°ė¾¶/nm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
×īøß»ÆŗĻ¼Ū»ņ×īµĶ»ÆŗĻ¼Ū | +1 | -1 | -3 | +3 | -2 | +3 | +1 | +1 |
øł¾ŻŌŖĖŲÖÜĘŚĀÉ£¬ÅŠ¶ĻĻĀĮŠĶʶĻ²»ÕżČ·µÄŹĒ( )
A.ŌŖĖŲaÓėŌŖĖŲcŠĪ³ÉµÄ»ÆŗĻĪļ·Ö×ÓÖŠµÄ»Æѧ¼üŹĒ¼«ŠŌ¼ü
B.bŌŖĖŲŠĪ³ÉµÄĒā»ÆĪļ·Ö×Ó¼ä“ęŌŚĒā¼ü
C.eŌŖĖŲĪ»ÓŚŌŖĖŲÖÜĘŚ±ķÖŠµÄµŚ¶žÖÜĘŚVIA×å
D.ŌŖĖŲfµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļÄÜČÜÓŚŌŖĖŲhµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļµÄĖ®ČÜŅŗÖŠ
 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
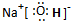
| ||
| ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā


| ||
| ||
 2SO3£Øg£©£»”÷H=-196.6KJ?mol-1£®Ę½ŗāŹ±ČŻĘ÷ÄŚĘųĢåŃ¹ĒæĪŖĘšŹ¹Ź±µÄ90%£®
2SO3£Øg£©£»”÷H=-196.6KJ?mol-1£®Ę½ŗāŹ±ČŻĘ÷ÄŚĘųĢåŃ¹ĒæĪŖĘšŹ¹Ź±µÄ90%£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
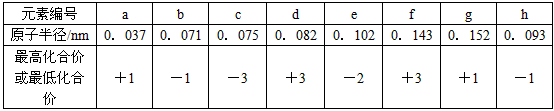
ŌŖĖŲ±ąŗÅ | a | b | c | d | e | f | g | h |
Ō×Ó°ė?¾¶/nm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
×īøß»ÆŗĻ¼Ū»ņ×īµĶ»ÆŗĻ¼Ū | +1 | -1 | -3 | +3 | -2 | +3 | +1 | +1 |
øł¾ŻŌŖĖŲÖÜĘŚĀÉ£¬ÅŠ¶ĻĻĀĮŠĶʶĻ²»ÕżČ·µÄŹĒ
A.ŌŖĖŲaÓėŌŖĖŲcŠĪ³ÉµÄ»ÆŗĻĪļ·Ö×ÓÖŠµÄ»Æѧ¼üŹĒ¼«ŠŌ¼ü
B.bŌŖĖŲŠĪ³ÉµÄĒā»ÆĪļ·Ö×Ó¼ä“ęŌŚĒā¼ü
C.eŌŖĖŲĪ»ÓŚÖÜĘŚ±ķÖŠµÄµŚ¶žÖÜĘŚ¢öA×å
D.ŌŖĖŲfµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļÄÜČÜÓŚŌŖĖŲhµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®ČÜŅŗÖŠ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ0103 ĘŚÖŠĢā ĢāŠĶ£ŗµ„Ń”Ģā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com