
| A. | 硫酸亚铁 | B. | 硫酸锌 | C. | 硝酸钾 | D. | 氯化钠 |
分析 铜粉与稀硫酸不反应,可以与稀硝酸反应,原来溶液中存在氢离子,有硝酸根离子存在时具有强氧化性.
解答 解:A.金属铜和稀硫酸不反应,加入FeSO4也不反应,故A不选;
B.金属铜和稀硫酸不反应,加入ZnSO4也不反应,故B不选;
C.金属铜和稀硫酸不反应,加入KNO3,在酸性条件下,有很强的氧化性,能和金属铜发生反应,发生反应的离子方程式应该是:8H++2NO3-+3Cu=3Cu2++4H2O+2NO↑,故C选;
D.金属铜和稀硫酸不反应,加入氯化钠也不反应,故D不选.
故选C.
点评 本题考查金属铜的性质,难度不大,要注意铜粉与稀硝酸可以反应,可以直接加入硝酸,也可以先加盐酸或硫酸,再加入硝酸盐.


科目:高中化学 来源: 题型:选择题
| A. | 甲苯分子中的所有原子可能共平面 | |
| B. | CH2═CH-C6H5分子中的所有原子可能共平面 | |
| C. | 乙烷分子中的所有原子可能共平面 | |
| D. | 二氯甲烷分子为正四面体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
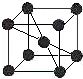 A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:
A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:| A | B | |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| … | E | A | B | ||
| C | … | D |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
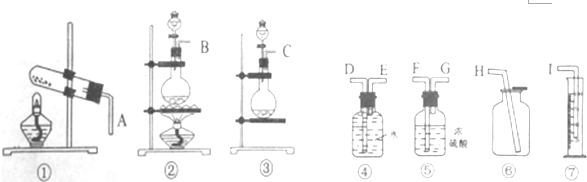
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若pH=7,HA的浓度一定为0.1 mol•L-1 | |
| B. | 若pH>7,HA的pH不可能等于1 | |
| C. | 若pH<7,溶液中的微粒浓度关系为:c(Na+)=c(HA)+c(A-) | |
| D. | 若pH=12,且HA为强酸时,HA的浓度应为0.08 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定醛 | B. | 丙醛 | C. | 乙醛 | D. | 甲醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

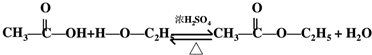 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com