
(13分)
海水是巨大的化学资源宝库。
Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。
(1)Cl2的电子式是 。
(2)已知:X2 (g)+H2(g) 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。
下图表示平衡常数K与温度t的关系。

①ΔH 表示X2与H2反应的焓变,ΔH 0。(填“>”、“<”或“=”)
② 曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与t的关系。
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是 。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。

① 装置中由NaCl转化为NaClO的化学方程式是 。
② 海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是 。
③ 若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。
试用电极反应式并结合必要的文字进行解释 。
(13分)
Ⅰ.(1)  (1分);
(1分);
 (2)① <(2分);
(2)① <(2分);
② Cl2(2分)。
Ⅱ.(1)Al3++3H2O Al(OH)3+3H+ (2分);
Al(OH)3+3H+ (2分);
(2)① 2NaCl+2H2O  2NaOH+Cl2+H2↑ (1分);
2NaOH+Cl2+H2↑ (1分);
2NaOH+Cl2=NaClO+NaCl+H2O (1分);
② Ca2++HCO3-+OH-=CaCO3↓+H2O (2分);
③ 阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的。 (2分)
【解析】
试题分析:Ⅰ.(1)氯气分子中的Cl原子之间形成1对共用电子对,所以电子式为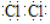
(2)①由图可知,每条曲线都是随温度升高,K值减小,所以升高温度,平衡逆向移动,正反应是放热反应,ΔH<0;
②同一温度时,a曲线的K值最大,说明卤素单质与氢气化合的能力最强,Cl2、Br2和I2中Cl2的氧化性最强,所以最易与氢气化合的是氯气,所以a曲线表示Cl2与H2反应时K与t的关系。
Ⅱ.(1)明矾中的铝离子水解生成氢氧化铝胶体,具有较大的吸附面积,降低浊度。水解的离子方程式为Al3++3H2O Al(OH)3+3H+ ;
Al(OH)3+3H+ ;
(2)① 此装置是电解装置,海水中的氯化钠电解生成氯气、氢气、氢氧化钠,装置中不存在隔气装置,使生成的氯气与氢氧化钠反应生成了次氯酸钠,化学方程式为2NaCl+2H2O 2NaOH+Cl2+H2↑,2NaOH+Cl2=NaClO+NaCl+H2O;
2NaOH+Cl2+H2↑,2NaOH+Cl2=NaClO+NaCl+H2O;
②装置的阴极是氢离子放电,导致阴极的OH-离子浓度增大,与海水中的HCO3-反应生成CO32-,再与Ca2+结合生成碳酸钙沉淀,化学方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O;
③每隔5-10 min倒换一次电极电性,则阴极变阳极,阳极是氯离子放电生成氯气,2Cl--2e-=Cl2↑,氯气溶于水生成盐酸和次氯酸,Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的。
考点:考查氯元素及其化合物的性质,电子式的书写,化学平衡常数的判断,对图像的分析能力,电化学的原理应用


科目:高中化学 来源:2013-2014吉林松原市高二下学期期末化学试卷(解析版) 题型:选择题
下列叙述错误的是
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
A.①③ B.②④ C.②⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林市高一化学下学期期末教学质量检测试卷(解析版) 题型:选择题
原电池反应是释放能量的氧化还原反应,下列可设计成原电池的化学反应是
A.H2O (l)+CaO(s) =Ca(OH)2(s) B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
C.2KClO3 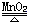 2KCl+3O2↑ D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
2KCl+3O2↑ D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市通州区高考二模理综化学试卷(解析版) 题型:填空题
(14分)已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系
中SO3的百分含量和温度的关系如右图所示(曲线上
点均为平衡状态)。由图可知:
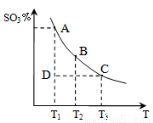
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
②若温度为T1时,反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为 、 ;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO 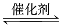 2CO2+N2。它的优点是 ;
2CO2+N2。它的优点是 ;
(3)有人设想用图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。

①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2
的体积分数为1%)的速率为 L/min(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市通州区高考二模理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4
B.亚硫酸氢钠溶液呈酸性:HSO +H2O
+H2O H3O++SO
H3O++SO
C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
D.稀硝酸洗涤试管内壁的银镜:Ag+2H++NO =Ag++NO↑+H2O
=Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区高三二模理综化学试卷(解析版) 题型:选择题
已知:Li与Mg、Be与Al的性质相似。下列判断正确的是
A.LiOH是强碱
B.Be与冷水剧烈反应
C.Li在空气中不易被氧化
D.Be(OH)2能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区下学期高二年级期末考试化学试卷(解析版) 题型:选择题
(10分)某物质E可做香料,其结构简式为 ,工业合成路线如下:
,工业合成路线如下:
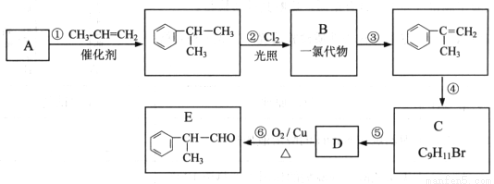
回答下列问题:
(1)A为芳香烃,相对分子质量为78。下列关于A的说法中,正确的是____________(填序号);
A. 密度比水大 B. 所有原子均在同一平面上 C. 一氯代物只有一种
(2)B的结构简式可能是____________、____________;
(3)步骤④的化学方程式是________________________;
(4)E有多种同分异构体,写出符合以下条件的结构简式____________(只写反式结构)。
①具有顺反结构 ②能与NaOH溶液反应 ③分子中苯环上的一溴代物有两种
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区下学期高二年级期末考试化学试卷(解析版) 题型:选择题
下列有机物中,不属于羧酸的是
A. 乙二酸 B. 苯甲酸 C. 石炭酸 D. 硬脂酸
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市海淀区高三第二学期二模理综化学试卷(解析版) 题型:简答题
(14分)
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
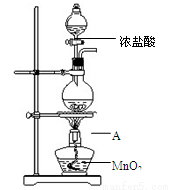
(1)仪器A的名称为 ;A中反应的离子方程式为 。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 |
|
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为 。
②不能证明产生的气体中含有HCl的实验是 (填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因: 。
(4)已知:2S2O32- + I2 === S4O62- + 2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 mol?L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 mol?L-1 AgNO3溶液滴定所得溶液中的Cl-。
X中的HClO不会影响I的测定结果,原因是 。
由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 mol?L-1 AgNO3溶液的体积应大于 mL(用含V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com