
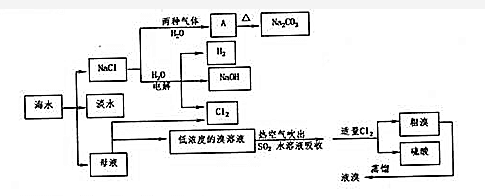
分析 (1)淡化海水,应降低水中的离子浓度,可用蒸馏法、离子交换法、电渗析法等;
(2)粗盐中含少量Ca2+、Mg2+、SO42-和泥沙等杂质,粗盐精制的过程中涉及常规操作步骤有:
①加水溶解;②依次加入过量的BaCl2、NaOH、Na2CO3溶液;③过滤除去沉淀;④加入适量的稀盐酸除去过量的氢氧化钠和碳酸钠;⑤蒸发浓缩、冷却结晶得到精盐;
(3)生成A的方法是侯氏制碱法,在制取A的过程中需向饱和NaCl溶液中先通入NH3,后通入气体的化学式为CO2,因为NH3极易溶于水,而CO2能溶于水,先通入氨气可吸收更多的CO2,才能生成NaHCO3;
(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度80℃-90℃时,水不沸腾而溴蒸气挥发;
(5)原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳,据此解答即可;依据转移电子数计算生成NaOH的质量,根据理论耗电量和实际耗电量计算得到.
解答 解:(1)常见淡化海水的方法有蒸馏法、离子交换法、电渗析法等,故答案为:蒸馏法;离子交换法、电渗析法;
(2)先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,则加入试剂顺序为NaOH,BaCl2,Na2CO3,HCl,加试剂Na2CO3后,杂质离子转化为沉淀,则应先进行一个实验操作为过滤,其中除去Mg2+所发生反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,
故答案为:NaOH,BaCl2,Na2CO3;Mg2++2OH-=Mg(OH)2↓;过滤;
(3)生成A的方法是侯氏制碱法.因为NH3极易溶于水,而CO2能溶于水,先通入氨气可吸收更多的CO2,这样才能生成NaHCO3,所以在制取NaHCO3的过程中需向饱和NaCl溶液中先通入NH3,后通入CO2,反应的化学方程式为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl,
故答案为:NH3、CO2;CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;
(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,
故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
(5)原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳,电极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+,烧碱溶液总含氢氧化钠的实际质量为:1.342×106×113×30%=45.49×106kg;理论上生成氢氧化钠的质量为:1.492×1.45×104×290×8=50.19×106kg;
该电解槽的电解效率η(NaOH)=$\frac{45.49×1{0}^{6}kg}{50.19×1{0}^{6}kg}$×100%=90.6%;
故答案为:CH3OCH3-12e-+3H2O=2CO2+12H+;90.6%.
点评 本题考查了海水的综合利用,包括海水提镁、提溴、淡化等;化学方程式、离子方程式的书写等知识,综合性较强.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 滴入酚酞显红色的溶液:Na+、NH4+、NO3-、Cl- | |
| B. | 0.1 mol•L-1 Fe(NO3)2溶液:H+、Al3+、SO4 2-、Cl- | |
| C. | 0.1 mol•L-1氨水溶液:K+、Na+、NO3-、AlO2- | |
| D. | c(H+):c(OH-)=1012mol•L-1的溶液:Ca2+、NH4+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | m+n<p | ||
| C. | 气体A的转化率升高 | D. | C气体的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
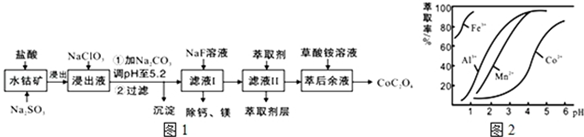
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
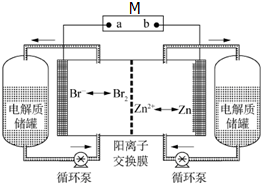 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )| A. | 锌溴液流电池总反应为:Zn+Br2═ZnBr2 | |
| B. | 放电时右侧电池电极发生氧化反应,电流从a极经用电器流向b极 | |
| C. | 放电时Zn2+从右侧经阳离子交换膜移向左侧,左侧电解质储罐中的离子总浓度增大 | |
| D. | 充电时左侧溴离子浓度下降,左侧电池电极连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
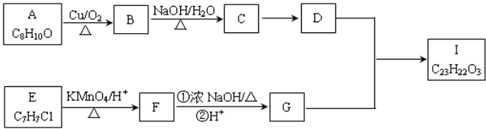
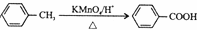
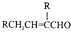
 .
. .
.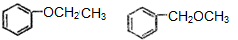 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向该溶液中加入过量NaOH溶液,仍能大量存在:ClO-、K+、CO32-、Cl- | |
| B. | 用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+ | |
| C. | 向该溶液中加入过量Ba(OH)2溶液,有白色沉淀生成2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 将该溶液蒸干、灼烧得到是K 2SO4和Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com