
| A. | 氢气的燃烧热△H=-241.6 kJ•mol-1 | |
| B. | 等质量的H2、CO完全燃烧时,CO释放的热量更多 | |
| C. | 煤的气化的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=-131.1 kJ•mol-1 | |
| D. | 煤炭完全燃烧释放1967.5 kJ热量时转移20 mol电子 |
分析 A.反应H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-241.6kJ•mol-1中生成的是气体水,而液态水更稳定;
B.根据热化学方程式分别计算出1g氢气和1个CO完全燃烧放出热量即可;
C.煤的气化为吸热反应,则焓变大于0;
D.根据①计算出释放1967.5 kJ热量消耗C的物质的量,然后根据1mol碳完全反应转移4mol电子进行计算.
解答 解:A.燃烧热中生成氧化物必须为稳定氧化物,液态水比气态水稳定,所以氢气的燃烧热△H<-241.6 kJ•mol-1,故A错误;
B.根据H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-241.6kJ•mol-1可知1g氢气燃烧放出热量为:$\frac{241kJ}{2}$=120.5kJ,根据CO(g)+O2(g)═CO2(g)△H3=-283.0kJ•mol-1可知1g CO完全燃烧放出的热量为:$\frac{283kJ}{28}$≈10.11kJ,显然质量相等时氢气燃烧放出的热量较多,故B错误;
C.煤的气化为吸热反应,正确的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.1 kJ•mol-1,故C错误;
D.释放1967.5 kJ热量消耗C的物质的量为:$\frac{1967.5kJ}{393.5kJ/mol}$=5mol,5molC完全反应转移电子的物质的量为:5mol×4=20mol,故D正确;
故选D.
点评 本题考查反应热与焓变的应用,题目难度不大,注意掌握热化学方程式的书写原则及表示的意义,明确燃烧热的概念为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
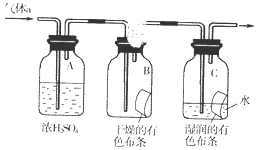 氯气是一种化学性质活泼的非金属单质,工业上可用氯气制取漂白粉、有机溶剂等.
氯气是一种化学性质活泼的非金属单质,工业上可用氯气制取漂白粉、有机溶剂等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO中少量的CO2 | 通过足量灼热CuO |
| B | 除去CuCO3中的少量CuO | 加入足量稀H2SO4后,过滤 |
| C | 鉴别澄清石灰水和NaOH溶液 | 加入稀HCl |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
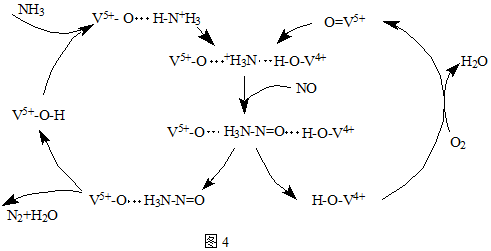
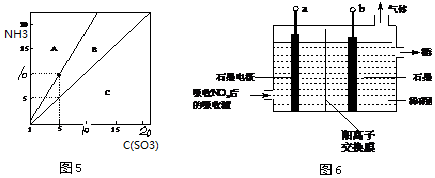
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
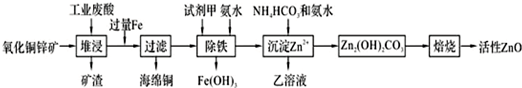
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL | B. | 200 mL | C. | 250 mL | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经处理变为气体燃料的过程属于物理变化 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 乙烷和乙醇均能发生取代反应 | |
| D. | 乙酸乙酯和植物油均可水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com