

| 2×3+1-4 |
| 2 |
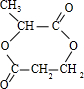 ,据此解答.
,据此解答.| 2×3+2-4 |
| 2 |
 ,
, ,
,| 浓硫酸 |
| △ |
 +2H2O,
+2H2O,| 浓硫酸 |
| △ |
 +2H2O;
+2H2O;

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
| A、K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 |
| B、Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即有气体产生 |
| C、Na+、Al3+、Cl-、SO42- 逐滴滴加NaOH先有沉淀产生,后沉淀消失 |
| D、NH4+、Mg2+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻又气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CO2) |
| n(H2) |
| 设备编号 | c(CO2) /mol?L-1 | c(H2) /mol?L-1 | c(CH3OCH3) /mol?L-1 | c(H2O) /mol?L-1 | v(正)和v(逆)比较 |
| Ⅰ | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)=v(逆) |
| Ⅱ | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
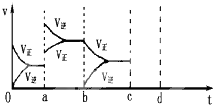 如图表示在密闭容器中反应:CO2(g)+C(s)?2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是
如图表示在密闭容器中反应:CO2(g)+C(s)?2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成原电池正极和负极的材料必须是两种金属 |
| B、由铜锌作为电极与硫酸铜溶液组成的原电池中,铜是负极 |
| C、电流通过硫酸溶液,SO42-向正极移动 |
| D、铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气还原氧化铜,当反应完成后,先停止加热再停止通氢气 |
| B、镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火 |
| C、纯锌与稀硫酸反应产生氢气的速度较慢,加入少量CuSO4固体,速度不改变 |
| D、用AgNO3溶液直接检验溴乙烷中的溴元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com