
分析 盐酸和醋酸钠之间反应生成氯化钠和醋酸,溶液显示中性,所以醋酸钠会剩余,c(H+)=c(OH-)=10-7mol/L,由于溶液体积加倍,则离子浓度均减半,故c(Cl-)=0.5bmol/L,而根据溶液的电中性可知:c(CH3COO-)+c(Cl-)=c(Na+)=0.5amol/L,所以c(CH3COO-)=(0.5a-0.5b)mol/L,根据醋酸的电离常数表达式来计算.
解答 盐酸和醋酸钠之间反应生成氯化钠和醋酸,溶液显示中性,所以醋酸钠会剩余,则生成的c(CH3COOH)=0.5bmol/L,溶液显中性,故c(H+)=c(OH-)=10-7mol/L,根据电荷守恒,c(Cl-)=0.5bmol/L,c(CH3COO-)+c(Cl-)=c(Na+)=0.5amol/L,所以c(CH3COO-)=(0.5a-0.5b)mol/L,
醋酸的电离常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{(0.5a-0.5b)×1{0}^{-7}}{0.5b}$=$\frac{1{0}^{-7}(a-b)}{b}$,故答案为:$\frac{1{0}^{-7}(a-b)}{b}$.
点评 本题考查了混合溶液中的弱电解质的电离平衡常数的计算,题目难度中等,注意计算过程中的电荷守恒和物料守恒的运用.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高温电解技术可将释放的CO2转化为具有工业利用价值的产品.反应方程式为CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2,其工作原理示意图如图.电极b上放出的气体X为O2,电极b连接Y为电源的正极(填正、负).
高温电解技术可将释放的CO2转化为具有工业利用价值的产品.反应方程式为CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2,其工作原理示意图如图.电极b上放出的气体X为O2,电极b连接Y为电源的正极(填正、负).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500 | 1 000 |
| c(H2)/mol•L-1 | 5.00 | 3.52 | 2.48 |
| c(CO)/mol•L-1 | 2.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
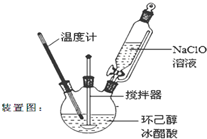 环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为:
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为: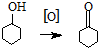
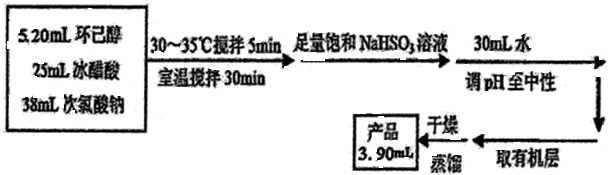
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com