
 A、B、C、D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( )
A、B、C、D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( )| A. | B 的M层电子数是K层的3倍 | |
| B. | C 的离子具有与 Na+相同的电子层结构 | |
| C. | A 与 D 形成的化合物属于离子化合物 | |
| D. | C 的简单阴离子比 D 的简单阴离子还原性强 |
分析 A、B、C、D四种短周期元素在周期表中的位置如图所示,结合元素周期表结构可知D位于第二周期,A、B、C位于第三周期;其中C的原子序数是D的原子序数的2倍,C比D的原子序数大8,则D为O、C为S元素;结合各元素的相对位置可知,B为P元素、A为Si元素,据此结合元素周期律知识解答.
解答 解:A、B、C、D四种短周期元素在周期表中的位置如图所示,结合元素周期表结构可知D位于第二周期,A、B、C位于第三周期;其中C的原子序数是D的原子序数的2倍,C比D的原子序数大8,则D为O、C为S元素;结合各元素的相对位置可知,B为P元素、A为Si元素,
A.B为P元素,其M层含有5个电子,B 的M层电子数是K层的$\frac{5}{2}$=2.5倍,故A错误;
B.C的两种为硫离子,含有3个电子层,钠离子含有两个电子层,两种离子的电子层结构不同,故B错误;
C.A 与D 形成的化合物为二氧化硅,二氧化硅为共价化合物,不是离子化合物,故C错误;
D.C 的简单阴离子为硫离子,D的简单阴离子阳离子,非金属性越强,对应离子的还原性越弱,则硫离子的还原性比氧离子的还原性强,故D正确;
故选D.
点评 本题考查位置、结构与性质关系的应用,题目难度不大,明确元素周期表结构为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的逻辑推理能力.


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:解答题

| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的硫酸溶液中含有的SO42-数目为0.05NA | |
| B. | 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA | |
| C. | 100mL 1mol/L CH3COONa 溶液中含有的CH3COO-数目为0.1NA | |
| D. | 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
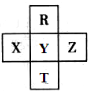 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )| A. | 原子半径 Z>Y>R | B. | R与Y的电子数相差8 | ||
| C. | 非金属性:Z>Y>X | D. | HZO4是目前无机酸中最强的含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
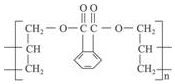 DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )
DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )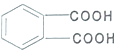
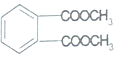
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋浸泡可除去水垢 | |
| B. | 用浓烧碱溶液作蚊虫叮咬处的淸洗剂 | |
| C. | 用明矾溶液的酸性淸除铜镜表面的铜锈 | |
| D. | 用浸泡过高锰酸钾溶液的硅土保存水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
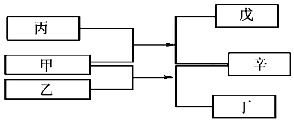 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )| A. | 元素B、C、D的原子半径由大到小的顺序为 r(D)>r(C)>r(B) | |
| B. | 1L0.lmol/L戊溶液中阴离子的总物质的量小于0.1mol | |
| C. | 1mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 元素的非金属性B>C>A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com